D- 97-11 : Programme de certification des pommes de terre de semence - Exigences concernant la production de semences Pré-Élite obtenues à partir de sources autres que le matériel nucléaire
Cette page fait partie du répertoire des documents d'orientation (RDO).
Vous cherchez des documents connexes?
Recherche de documents connexes dans le répertoire des documents d'orientation.
Entreé en vigueur : Le 2 mai 2012
(3e révision)
Objet
La présente directive contient les exigences concernant la production de pommes de terre de semence Pré-Élite à partir de matériel autre que le matériel nucléaire, c'est-à-dire des boutures, plantes, tubercules ou clones sélectionnés exempts de maladie Règlement sur les semences, R.C.C. ch. 1400, paragraphe 47(2). Dans la présente directive, on désignera ce matériel sous l'expression équivalente de matériel nucléaire.
La présente directive a été révisée pour mettre à jour la date prévue de révision ainsi que pour apporter des modifications administratives mineures. Le contenu de cette directive n'a pas été modifié.
Table des matières
- Révision
- Approbation
- Registre des modifications
- Liste de distribution
- Introduction
- Portée
- Définitions, abréviations et acronymes
- 1.0 Exigences générales
- 2.0 Exigences spécifiques
- 3.0 Annexes
- Annexe 1 : Diagramme de production de pommes de terre de semence Pré-Élite à partir d'autres sources que le matériel nucléaire (équivalent de matériel nucléaire)
- Annexe 2 : Méthode d'échantillonnage pour le dépistage de Clavibacter michiganensis subsp. sepedonicus (Spieckermann & Kotthoff 1914) Davis, Gillaspies, Vidaver & Harris 1984, agent causal du flétrissement bactérien, dans les pommes de terre de semence obtenues à partir d'un équivalent de matériel nucléaire
- Annexe 3 : Méthode d'échantillonnage pour les épreuves de dépistage des virus et des viroïdes (filosité des tubercules) affectant les pommes de terre de semence obtenues à partir d'un équivalent de matériel nucléaire
Révision
La présente directive sera révisée tous les trois ans, sauf indication contraire. Pour obtenir des précisions ou des renseignements supplémentaires, communiquer avec l'Agence canadienne d'inspection des aliments (ACIA).
Approbation
Approuvé par : Dirigeant principal de la protection des végétaux
Registre des modifications
Les modifications apportées à la présente directive seront datées puis distribuées selon la liste ci-dessous.
Liste de distribution
- Liste d'envoi des directives (régions, ERP, USDA)
- Gouvernements provinciaux, industrie (déterminées par l'auteur)
- Organisations sectorielles nationales (déterminées par l'auteur)
- Internet
Introduction
Malgré la tendance générale à adopter un programme à nombre restreint de générations, fondé au départ sur l'utilisation de plantules testées contre les maladies et cultivées in vitro (matériel nucléaire), on observe encore un certain intérêt pour l'utilisation d'autres sources de semences pour le démarrage des nouveaux champs de pommes de terre de semence. Aux fins de comparaison, les Pays-Bas, premier pays exportateur de pommes de terre de semence, recourent largement à la sélection clonale (processus par lequel la croissance des tubercules en champ est utilisé pour initier une nouvelle lignée de pommes de terre de semences) pour son propre système de certification des semences. On a donc souligné la nécessité de maintenir la possibilité d'opter pour ce système au Canada.
Portée
La présente directive précise les critères de production des pommes de terre de semence Pré-Élite à partir de matériel autre que le matériel nucléaire.
Définitions, abréviations et acronymes
Les définitions des termes utilisés dans le présent document se trouvent dans le Glossaire de la protection des végétaux.
1.0 Exigences générales
1.1 Fondement législatif
Loi sur les semences, L.R., 1985, ch. S-8
Règlement sur les semences, Partie II, R.C.C., ch. 1400
Avis sur les prix de l'Agence canadienne d'inspection des aliments, Partie I de la Gazette du Canada (tel que modifié de temps à autre)
1.2 Droits
L'ACIA impose des coûts conformément à l'avis sur les prix de l'Agence canadienne d'inspection des aliments. Pour obtenir des renseignements concernant les coûts associés aux produits importés, veuillez communiquer avec le Centre de service d'importation (SCI). Toute personne qui nécessite des renseignements relatifs aux droits peuvent communiquer avec un bureau local de l'ACIA.
1.3 Organismes réglementés
Plusieurs parasites réglementés par le Canada peuvent être associés aux marchandises et/ou articles réglementés par la présente directive. Des exemples notables de tels parasites sont énumérés ci après. Une liste plus exhaustive de parasites réglementés par le Canada se trouve sur le site Web de l'ACIA.
La liste des Parasites réglementés par le Canada ne comprend pas tous les organismes susceptibles d'être considérées comme un risque phytosanitaire pour le Canada. Lorsque un nouveau parasite est détecté sur des végétaux ou produits végétaux, celui-ci sera catégorisé et ajouté à la liste au besoin.
Virus : Virus de l'enroulement des feuilles (PLRV), PVA, PVM, PVS, PVX, PVY, Virus latent de la pomme de terre (Virus Red La soda-RLSV) et le virus du sommet touffu de la pomme de terre (PMTV).
Viroïdes : Viroïde de la filosité du tubercule (PSTVd)
Bactérie : C.m. sepedonicus, agent causal du flétrissement bactérien
2.0 Exigences spécifiques
Tout producteur qui a l'intention d'utiliser un équivalent de matériel nucléaire pour produire des pommes de terre de semence Pré-Élite doit se conformer aux exigences suivantes (diagramme à l'Annexe 1).
2.1 Sélection et récolte
Les plants-mères doivent être sélectionnés dans un champ certifié par l'Agence canadienne d'inspection des aliments (ACIA) selon le Règlement sur les semences, Partie II. Les clones sélectionnés sont spécifiquement choisis parce qu'ils expriment des caractères comme l'absence de symptômes visibles de maladies et de troubles physiologiques, l'uniformité du point vue de la taille et de la tubérisation, ainsi que la pureté variétale.
À ce stade, il est fortement recommandé, mais non obligatoire, de procéder à des essais au champ des plants-mères pour éliminer le matériel qui pourrait être infecté par des virus. Cela pourrait potentiellement permettre l'élimination de plants infectés par les virus, mais ne permettrait pas l'élimination complète de tous les plants infectés par une infection virale, ainsi un test post-récolte est obligatoire.
Il incombe aux producteurs de sélectionner, de manipuler, d'entretenir et de conserver les clones. Les producteurs doivent conserver la documentation sur les sources de semences, la sélection et l'identification des clones pour démontrer à l'inspecteur que l'intégrité du matériel sélectionné a été maintenue.
2.2 Épreuves
Les épreuves post-récolte sont obligatoires et garantissent l'élimination des plants atteints d'une infection virale. Étant donné, d'une part, la distribution inégale des maladies parmi les tubercules d'un clone sélectionné et, d'autre part, du fait que les tests en laboratoire ne permettent pas de déceler les agents pathogènes présents en faible concentration, tous les tubercules (ou leur descendance) des clones sélectionnés doivent être testés après la récolte, même si on ne prévoit pas en replanter la totalité pour produire les semences Pré-Élite.
Tous les essais de dépistage requis doivent être menés aux frais du producteur dans un laboratoire accrédité par l'ACIA. Une liste à jour des laboratoires accrédités peut être trouvée au site web de l'ACIA.
2.2.1 Épreuves de dépistage du Clavibacter michiganensis subsp. sepedonicus - flétrissement bactérien (FB)
Dans le cas du flétrissement bactérien, les épreuves doivent être réalisées directement sur les tubercules récoltés des clones sélectionnés. Les tests effectués sur la tige en serre ou au champ la saison suivante ou les tests sur des tubercules en serre sont considérés comme étant inacceptables.
Il faut prélever des cônes au talon de chaque tubercule issu du plant-mère et les tester à l'égard du Clavibacter michiganensis subsp. sepedonicus (Spieckermann & Kotthoff 1914) Davis, Gillaspies, Vidaver & Harris 1984, agent causal du flétrissement bactérien (voir l'Annexe 2 pour des précisions sur l'échantillonnage).
Si l'un des résultats de test est positif pour le flétrissement bactérien, tous les clones provenant de la même unité de production seront rejetés pour la production de semences Pré-Élite. De plus, toutes les mesures habituelles de lutte contre le flétrissement bactérien sur une unité de production seront appliquées.
2.2.2 Épreuves de dépistage des virus et des viroïdes
Les épreuves de dépistage des virus et des viroïdes peuvent être menées de deux façons :
- soit en serre pendant l'hiver (voir la partie 2.2.2.1 pour plus de précisions),
- soit au champ le printemps suivant la récolte (voir la partie 2.2.2.2 pour plus de précisions).
Si l'un ou l'autre des tests donne un résultat positif à l'égard de n'importe lequel des virus, le clone entier doit être rejeté pour la production de semences Pré-Élite. Les clones infectés peuvent demeurer éligibles à la certification pour des classes inférieures de semence, à condition qu'ils soient conformes aux exigences réglementaires.
Si un échantillon donne un résultat positif aux épreuves de dépistage de la filosité des tubercules, le certificat visant le lot entier de semences duquel provient le clone sera révoqué en vertu de l'alinéa 52(5)e) du Règlement sur les semences.
Lorsque les épreuves ont lieu au champ (tel qu'indiqué à la section 2.2.2.2), tous les clones pour lesquels les résultats sont positifs doivent être retirés du champ aux fins de certification pour les semences de classe Pré-Élite. Si cela n'est pas fait, le champ entier sera déclassé à une classe inférieure, à condition que toutes les autres exigences réglementaires soient respectées.
2.2.2.1 Épreuves de dépistage des virus et des viroïdes en serre pendant l'hiver (première option)
On peut faire germer et/ou cultiver un oeil de chaque tubercule du clone. Au moment de l'enlèvement de l'oeil, il faut éviter toute possibilité de contamination croisée entre les clones. Pour réduire ce risque, on recommande de désinfecter les couteaux et l'équipement entre chaque excision sur chaque tubercule. Les tissus de feuilles ou de germes produits à partir de chaque oeil excisé doivent subir les épreuves de dépistage de l'enroulement des feuilles, de la filosité des tubercules, des virus PLRV, PSTVd, PVA, PVM, PVS, PVX, PVY, RLSV et PMTV (voir l'Annexe 3 pour plus de précisions). Les clones de la même variété, qui ont donné des résultats négatifs à l'égard de toutes les maladies, peuvent être plantés en vrac, et il n'est pas nécessaire de les garder séparés, car aucune autre épreuve n'est requise.
2.2.2.2 Épreuves de dépistage des virus et des viroïdes au champ le printemps suivant la récolte des clones sélectionnés (deuxième option)
Après la plantation des clones sélectionnés le printemps suivant la récolte, on prélève les trois folioles terminales des jeunes feuilles composées complètement ouvertes d'au moins un plant de chaque tubercule individualisé pour mener les épreuves de dépistage de l'enroulement des feuilles, de la filosité des tubercule, des virus PLRV, PSTVd, PVA, PVM, PVS, PVX, PVY, RLSV et PMTV (voir l'Annexe 3 pour plus de précisions sur l'échantillonnage). Chaque clone doit être dûment identifié et planté séparément au champ. Les clones doivent être plantés de manière à ce qu'il n'y ait aucun contact possible entre eux avant le retrait des clones infectés. Les semences coupées doivent être plantées en tant que tubercules individualisés, et l'on doit respecter l'espacement prévu entre chacun.
2.3 Multiplication ultérieure
Quand les tubercules sont testés (selon la section 2.2.1) et qu'il est confirmé qu'ils sont exempts de maladie, on peut procéder à une autre multiplication avant l'ensemencement au champ. Les boutures doivent être produites dans un milieu protégé. Il n'est pas nécessaire de les retester. Si le processus de multiplication a commencé avant la fin des épreuves requises, il faut veiller à éviter toute possibilité de contamination croisée entre les clones, et chaque clone doit être isolé et clairement identifié.
Les plants testés au champ (conformément à la section 2.2.2) peuvent être plantés seulement comme semences entières ou être multipliés en tranchant les tubercules. Au moment de trancher ces derniers, il faut redoubler de vigilance pour éviter la contamination croisée entre les clones. Pour réduire ce risque, il est recommandé de désinfecter les couteaux et l'équipement entre le sectionnement pour chaque tubercule.
2.4 Demande de certification
Le demande d'inspection sur pied pour pommes de terre de semence sera la même que celle que l'on soumet pour la production de semences Pré-Élite obtenues à partir de matériel nucléaire. Au moment de la première inspection ou plus tôt, le demandeur doit démontrer qu'il a complété tous les tests à la satisfaction de l'inspecteur. De plus, il doit mettre en permanence à la disposition de l'inspecteur la documentation sur la sélection des clones, l'identification de ces derniers, les résultats d'analyse, etc.
3.0 Annexes
Annexe 1 : Diagramme de production de pommes de terre de semence Pré-Élite à partir d'autres sources que le matériel nucléaire (équivalent de matériel nucléaire)
Cliquer sur l'image pour l'agrandir
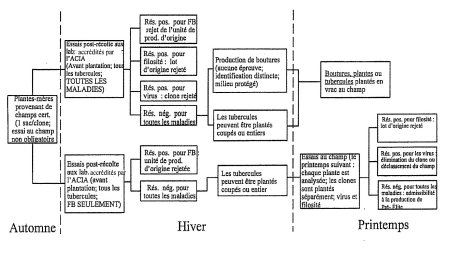
Description de l'Organigramme : Production de pommes de terre de semence Pré-Élite à partir d'autres sources que le matériel nucléaire (équivalent de matériel nucléaire)
L'annexe un présente le plan d'échantillonnage pour les tests au laboratoire dans le cadre de la production de pommes de terre de semence Pré-Élite provenant d'autres sources que de matériel nucléaire. Suite à la récolte des échantillons à l'automne, deux options pour le dépistage des maladies sont décrites. Dans la première, tous les tests de dépistage ont lieu durant l'hiver et, si les résultats le permettent, la plantation peut avoir lieu au printemps. Dans la seconde, les tests pour le flétrissement bactérien ont lieu pendant l'hiver et les tests pour les autres maladies se font au printemps sur les plants individuels après plantation au champ. Le champ peut-être classé Pré-Elite si les résultats le permettent.
Annexe 2 : Méthode d'échantillonnage pour le dépistage de Clavibacter michiganensis subsp. sepedonicus (Spieckermann & Kotthoff 1914) Davis, Gillaspies, Vidaver & Harris 1984, agent causal du flétrissement bactérien (FB), dans les pommes de terre de semence obtenues à partir d'un équivalent de matériel nucléaire
Échantillonnage
- Seuls les tubercules seront testés pour le dépistage du flétrissement bactérien. Tous les tubercules provenant des clones sélectionnés doivent être testés; par conséquent, on présume que le carottage sera effectué par le producteur et que les carottes-échantillons seront envoyées directement au laboratoire. Une fois les carottes expédiées, le producteur conservera les tubercules échantillonnés au cas où il faudrait effectuer d'autres analyses.
- Les morceaux de tubercule, de forme conique ou semi-sphérique, doivent être prélevées au point d'attache du stolon et mesurer environ 1 cm de diamètre dans le haut et 1 cm de longueur (voir le diagramme 1). Chaque morceau doit peser de 0,5 à 1 g et comprendre la plus grande partie possible de l'anneau vasculaire qui rayonne autour de ce point.
Diagramme 1 : Méthode pour prélever une carotte d'un tubercule
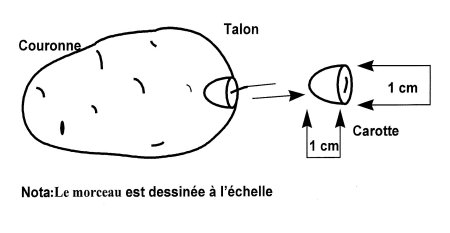
Description de Diagramme 1 : Méthode pour prélever une carotte d'un tubercule
Le diagramme un démontre comment prendre un échantillon carotte du côté talon du tubercule. L'échantillon doit avoir un centimètre de long par un centimètre de diamètre.
Regroupement des échantillons
- Étant donné que les mesures de suivi visant un échantillon positif (flétrissement bactérien seulement) ne sont prises que pour un lot d'origine seulement, il n'est pas nécessaire d'ensacher et de soumettre les échantillons au laboratoire par clone; les clones provenant du même lot d'origine peuvent être soumis au laboratoire en tant qu'échantillon unique. Toutefois, les clones doivent être identifiés sur le sac.
- Chaque échantillon est inscrit séparément par le laboratoire. Toutefois, selon les protocoles officiels, les échantillons peuvent être regroupés par le laboratoire aux fins d'analyse.
- Au maximum, le laboratoire peut regrouper 200 morceaux de tubercules pour l'analyse (lorsqu'un sac contient plus de 200 morceaux, cet échantillon est subdivisé). Toutefois, si une analyse est positive, il faut pouvoir remonter jusqu'au numéro du lot. Le matériel gardé en réserve (tubercules dont proviennent les morceaux conservés au laboratoire ou chez le producteur) peut être utilisé pour l'analyse d'échantillons composites. Les échantillons provenant de différentes unités de production ne peuvent être regroupés en un seul échantillon de laboratoire.
- Il existe de nombreuses options pour la présentation des échantillons au laboratoire (certaines permettant de réduire les coûts). Il est donc conseillé de communiquer avec le laboratoire pour prendre les dispositions nécessaires.
Emballage et expédition
- Pour garantir la continuité de traitement de l'échantillon du champ jusqu'au laboratoire, il est essentiel d'appliquer les méthodes appropriées pour l'emballage, le transport et l'identification. Si l'intégrité de l'échantillon est jugée douteuse, celui-ci sera rejeté et il faudra en soumettre un autre.
- Comme les morceaux de tubercule séché et enveloppés dans des essuie-tout peuvent être conservées au froid (4 °C) 14 jours au maximum avant d'être analysés, il est important qu'ils demeurent toujours au froid. Les échantillons ne peuvent se conserver aussi longtemps qu'en l'absence de décomposition. Le laboratoire éliminera les morceaux de tubercule et les tiges qui ont pourri pendant le stockage et exigera un nouvel échantillon.
- Les morceaux de tubercules et les tiges doivent être aussi secs que possible au moment de l'emballage; il faut les envelopper dans des essuie-tout et les mettre dans des sacs en plastique pour le transport. Les morceaux de tubercules doivent être ensachés par lot d'origine. Chaque sac doit être dûment identifié (voir la partie Identification ci-après). Il faut fermer les sacs et les réfrigérer dès que possible, au plus tard deux heures après les prélèvement des morceaux de tubercules. Les sacs doivent être conservés au froid (4 °C) suffisamment longtemps (p. ex. toute la nuit) et doivent être disposés (bien étalés) de façon à ce que toutes les composantes de l'échantillon aient atteint 4 °C au moment de l'emballage. S'assurer que la taille de l'échantillon indiquée sur les sacs est exacte; le laboratoire n'acceptera pas d'écart de plus de 2 % par rapport au nombre déclaré.
- Placer ensuite les sacs sans les tasser dans boîtes en carton isolées. Il faut placer des contenants réfrigérants sur le dessus (car l'air froid descend) en veillant à les isoler suffisamment pour que les spécimens ne gèlent pas.
- Il est important de se rappeler que les contenants réfrigérants ne sont pas efficaces longtemps; leur effet refroidissant dure de 24 à 48 heures, selon l'isolant. Il faut donc différer l'envoi des échantillons qui risquent d'être retenus en transit la fin de semaine ou pendant un congé, à moins qu'ils puissent être gardés dans des installations réfrigérés.
- Quand on emballe plusieurs échantillons dans le même contenant, la liste complète des échantillons soumis doit être apposée sur le dessus de chaque contenant d'expédition ou doit accompagner le connaissement; cette liste doit être signée par la personne qui a prélevé les échantillons.
- Pour garantir la continuité de traitement de l'échantillon, les emballages doivent être correctement scellés de façon qu'il soit impossible de les ouvrir ou d'en modifier le contenu en transit (transport) sans que le personnel du laboratoire ne s'en rende compte. Si son intégrité est jugée douteuse, l'échantillon sera rejeté et il faudra en soumettre un nouveau.
- Lorsque la température extérieure peut descendre sous le point de congélation (0 °C), il faut éviter que l'échantillon ne gèle, car le laboratoire rejettera tout échantillon présentant des signes de gel.
Identification
- Les échantillons de chaque lot d'origine doivent être soumis dans un sac fermé distinct, et être étiquetés individuellement. Les renseignements suivants doivent figurer sur chaque étiquette :
- nom du producteur (tel que l'exige la demande actuelle d'inspection de la récolte de pommes de terre de semence)
- nom de la variété
- numéro de certificat du lot d'origine et des clones
- identification des clones contenus dans le sac
- qualité (à assigner/déjà assignée)
- nombre de carottes soumises
- date de prélèvement
- signature du producteur ou de son représentant
- nom de l'essai pour lequel l'échantillon est soumis
- À noter : les échantillons qui ne sont pas correctement identifiés ne seront pas traités par le laboratoire tant que ce dernier n'aura pas reçu l'identification exacte.
Annexe 3 : Méthode d'échantillonnage pour le dépistage des virus et des viroïdes (filosité des tubercules) dans les pommes de terre de semence obtenues à partir d'un équivalent de matériel nucléaire
Échantillonnage
- Dans tous les cas (champ ou serre) où l'échantillonnage doit être réalisé pour des pommes de terre de semence obtenues à partir d'un équivalent de matériel nucléaire, il faut échantillonner chaque tubercule individualisé.
- Le laboratoire procédera à l'analyse du matériel provenant des feuilles ou des germes. Il faut soumettre les trois folioles terminales d'une jeune feuille composée entièrement ouverte provenant d'un plant de chaque tubercule individualisé (voir le diagramme 2). À leur arrivée au laboratoire, les échantillons acceptables doivent comprendre au moins 2 cm2 de tissu foliaire intact par foliole. Un léger flétrissement ou bris du bord des feuilles est toléré.
Les feuilles sont prélevées au tiers supérieur de la plante dès que les premières feuilles composées s'ouvrent et toujours avant le début de la sénescence des plantes. Lorsque les essais sont menés au champ, l'échantillonnage doit avoir lieu suffisamment tôt pour que tout prélèvement subséquent à l'obtention de résultats positifs puisse être réalisé avant qu'aucune contamination ne survienne, peu importe le moyen,(insectes, transmission mécanique par la machinerie, contact entre les plants, etc.)
Les germes d'au moins 1,5 cm doivent être prélevés sur des tubercules qui ont été maintenus entre 18 et 25 °C.
Diagramme 2 : Échantillonnage des feuilles pour le dépistage des virus
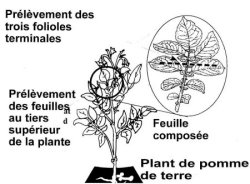
Description de Diagramme 2 : Échantillonnage des feuilles pour le dépistage des virus
L'annexe trois illustre comment faire l'échantillonnage des feuilles sur un plant de pomme de terre. On y montre les trois folioles terminales d'une feuille composée et des instructions sont données afin de prendre l'échantillon dans le tiers supérieur de la plante.
Dans la plupart des cas, les protocoles officiels exigent que les essais soient effectués dans les 72 heures suivant le prélèvement des feuilles ou des germes; communiquer avec le laboratoire local pour obtenir plus de précisions à cet égard.
Emballage
- Selon les protocoles officiels, il est possible d'analyser des échantillons composites. Plusieurs options permettent de réduire les coûts; il est donc préférable de communiquer avec le laboratoire local pour prendre les arrangements nécessaires. Toutefois, lorsqu'un essai donne des résultats positifs, il faut identifier le clone en cause. Quand les échantillons composites de plus d'un clone sont analysés (diminution des coûts), le matériel de suivi, soit les deux folioles restantes (seule la foliole terminale subit la première épreuve), peut servir à pousser l'analyse des échantillons positifs au besoin.
- Les feuilles et les germes doivent être ensachés par clone, et le clone doit être dûment identifié. Pour sceller le sac, il suffit d'en replier lâchement l'ouverture et de l'agrafer. Le sac ne doit pas être fermé de manière hermétique, en particulier si le temps est chaud et humide; au besoin, il faut pratiquer des trous d'aération.
- Les échantillons de feuilles ou de germes doivent être refroidis (mais pas congelés) à 5 °C aussitôt que possible, soit dans l'heure qui suit leur cueillette (en particulier par temps chaud). Si l'on se sert de « contenants réfrigérants », ceux-ci doivent être isolés par deux ou trois couches de papier ou d'autre matériel d'emballage, et être placés au milieu ou sur le dessus de la glacière. Habituellement, l'emploi de deux « contenants réfrigérants » de 6" x 6" par glacière suffit. Éviter de comprimer les feuilles dans l'emballage.
Expédition
- Si les feuilles doivent être expédiées par service de messagerie, elles doivent être conservées toute la nuit dans un endroit réfrigéré. Pour l'envoi, il faut emballer les sacs de manière lâche dans des contenants de styromousse et les placer dans des boîtes de carton. Il faut également y ajouter des « contenants réfrigérants », mais ceux-ci doivent être suffisamment isolés pour ne pas que les feuilles gèlent.
- Il faut respecter le délai maximal de 72 heures indiqué ci-dessous (échantillonnage, paragraphe 3).
Identification (pour assurer la continuité de traitement de l'échantillon du champ jusqu'au laboratoire)
- Chaque sac doit porter l'information suivante : nom du producteur ou de l'entreprise, signature du producteur, date de livraison, variété, qualité et numéro de certificat. Tel que susmentionné, tous les clones doivent être identifiés séparément.
- Une liste complète du contenu doit être placée sur le dessus des échantillons ou avec le connaissement et être signée par la personne qui a prélevé les échantillons.
- Les dates de prélèvement et de présentation de chaque échantillon doivent également être précisées.
- Les emballages doivent être dûment scellés.
À noter :
- Les échantillons qui ne sont pas dûment identifiés ne seront pas analysés tant que le laboratoire n'aura pas reçu l'identification exacte.
- Si l'intégrité de l'échantillon est remise en question, l'échantillon sera rejeté et il faudra en soumettre un autre.
- L'envoi des échantillons doit être retardé s'il est évident que l'emballage sera retenu en transit pendant un congé ou la fin de semaine.
- Date de modification :