Annexe T-1 : Directive de Conformité – Exigences de Surveillance Microbiologique des Procédés Dans les Abattoirs de Bétail et de Ratites
Sur cette page
- Partie I - Exigences générales
- 1 – Introduction
- 2 - Exigences relatives au programme d'échantillonnage et d'analyse de surveillance microbiologique à élaborer par l'exploitant
- 3 - Politiques générales d'échantillonnage
- 4 - Exigences pour les laboratoires
- 5 - Critères de rendement
- 6 - L'approche de la fenêtre mobile
- 7 - Contrôle statistique de procédé
- Partie II - Exigences spécifiques d'échantillonnage
- Partie III - Activités de vérification et mesures d'application de Agence canadienne d'inspection des aliments
- Addenda 1 - Tableau sommaire sur le dépistage
- Addenda 2 - Procédures spécifiques de prélèvement d'échantillons
- Addenda 3 - Il s'agit d'une information technique fournie à titre indicatif en cas de prélèvement d'un micro-organisme
- Addenda 4 - Figures et illustrations
- 4.1 Exemple de gabarit d'échantillonnage
- 4.2 Site d'échantillonnage pour les tests de dépistage de E. coli sur les bovins, les ovins, les caprins et les équins
- 4.3 Sites d'échantillonnage (épongeage) des carcasses non-écorchées
- 4.4 Sites d'échantillonnage pour les tests de dépistage de E. coli sur les carcasses de porcs
- 4.5 Graphique de contrôle de procédé - exemple
Partie I - Exigences générales
1 – Introduction
Le règlement du Food Safety and Inspection Service (FSIS), spécifiquement le Titre 9 du Code du règlement fédéral 310.18 (c) et (d): Contamination des carcasses, des organes ou d'autres parties, 310.25 (a): Contamination par des micro-organismes; critères et tests de vérification du contrôle des processus; normes de réduction des agents pathogènes et 381.94 (a): Contamination par des micro-organismes; critères de vérification du contrôle des processus et tests; normes de réduction des agents pathogènes pour les établissements abattant des ratites Title 9 Code of Federal Regulation 310.18 (c) et (d) : Contamination of carcasses, organs, or other parts, 310.25(a): Contamination with microorganisms; process control verification criteria and testing; pathogen reduction standards et 381.94(a): Contamination with microorganisms; process control verification criteria and testing; pathogen reduction standards for establishments that slaughter ratites), oblige les exploitants d'abattoirs à effectuer des prélèvements pour analyse microbiologique sur les carcasses de bétail (bovins, porcs, ovins, caprins et équidés) et de ratites qu'ils abattent. Ils doivent mettre en œuvre des programmes d'analyse microbiologique pour mesurer et surveiller l'efficacité de leurs mesures de contrôle d'hygiène des procédés (habillage et assainissement) visant à prévenir la contamination des produits de viande comestibles.
Les exploitants d'abattoirs canadiens autorisés à exporter des produits de viande provenant de bétail et de ratites vers les É-U doivent intégrer dans leur Système d'analyse des risques et de maîtrise des points critiques (HACCP) des procédures écrites d'analyse microbiologique pour mesurer et surveiller la performance de leur mesures de contrôles de procédés en utilisant soit les critères de rendement établis par le FSIS ou soit, en l'absence de tels critères, des critères de rendement statistiques qu'ils doivent établir au moyen de technique de contrôle statistique de procédé. Les exploitants sont tenus de prendre les actions correctives appropriées lorsque les résultats des tests effectués indiquent une perte de contrôle des procédés.
Le programme d'échantillonnage et d'analyse de surveillance élaboré, mis en œuvre et maintenu par l'exploitant doit tenir compte de tous les éléments applicables des exigences énoncées dans la présente annexe.
Agence canadienne d'inspection des aliments (ACIA) surveillera la mise en œuvre par l'exploitant du programme de surveillance microbiologique requis.
2 - Exigences relatives au programme d'échantillonnage et d'analyse de surveillance microbiologique à élaborer par l'exploitant
Les programme doit être suffisamment détaillé pour permettre une vérification des activités d'échantillonnage et doit inclure les éléments suivants :
- une liste des espèces animales (bétail/ratites) abattues dans l'établissement par ordre décroissant de volume d'abattage
- une description des méthodes de prélèvement, y compris la manière dont la sélection aléatoire est réalisée, la façon dont l'échantillon est prélevé, la technique aseptique et la manière dont les échantillons sont manipulés pour garantir leur intégrité, par exemple les paramètres de température, la date et l'heure de la collecte, les mesures de prévention de falsification; et le nom et le titre du ou des employés désigné(s) de l'établissement (EDE) chargé(s) de prélever les échantillons pour les tests
- préparation pré-échantillonnage : par exemple, liste de contrôle des tâches à effectuer avant le prélèvement des échantillons, matériel nécessaire au prélèvement des échantillons, vérification de la convenance des matériaux avant le test (par exemple : vérification des éponges pour s'assurer qu'elles n'ont pas de propriétés bactéricides)
- renseignements sur la méthodologie utilisée pour analyser les échantillons et identifier le laboratoire qui effectue les analyses. La méthode utilisée devrait être validée par un organisme scientifique indépendant reconnu, tel que l'Association of Official Analytical Chemists (AOAC)
- l'indicateur microbien ciblé (i.e., E. coli biotype 1 ou autres micro-organismes indicateurs, tels que la numération aérobie sur plaque (NAP), les coliformes totaux et les enterobacteriaceae)
- le lieu dans le procédé où les échantillons sont collectés
- la fréquence de la collecte des échantillons, le site et la méthode d'échantillonnage
- les procédures d'expédition (le cas échéant) : par exemple, qui emballe, où l'emballage est-il effectué, où les échantillons sont-ils conservés en attendant l'expédition, qui expédie les échantillons ; où les échantillons sont-ils expédiés (laboratoire)/comment les échantillons sont-ils expédiés (agent d'expédition), chaîne de possession
- compilation et analyse des résultats / activités de tenue de dossiers: par exemple, unité de mesure, qui reçoit les résultats des tests, qui examine et compile les résultats, où seront conservés les rapports/feuilles de travail du laboratoire (tableau ou graphique), combien de temps les registres sont-ils conservés, comment le vétérinaire responsable de l'ACIA (VR) a-t-il accès aux résultats?
- les critères de rendement du FSIS qui seront utilisés, c'est-à-dire les valeurs "m" et "M", ou en l'absence de tels critères, la méthode utilisée pour établir les critères de rendement statistiques des contrôles de procédé, les limites établies et la représentation graphique des résultats des tests
- activités de surveillance/vérification internes à mener pour assurer la réalisation du programme d'échantillonnage tel qu'il a été conçu
- procédures de rectification: par exemple, pour les résultats non concluants, pour le non-respect des procédures lorsque constaté lors des activités de vérification interne de l'exploitant, pour les résultats de E. coli (ou autres micro-organismes, le cas échéant) dépassant les seuils d'intervention signe d'une perte de contrôle des procédés
Remarque : Il est possible de faire référence aux procédures générales de prélèvement d'échantillons d'un établissement, à condition que les références se rapportent aux sections spécifiques de la procédure et que les détails spécifiques à ce programme d'échantillonnage soient fournis. Les procédures devraient également être intégrées dans le système HACCP de l'établissement.
Le VR de l'ACIA examinera le programme pour vérifier que toutes les exigences énoncées dans la présente annexe sont respectées.
Le programme de l'exploitant sera mis à la disposition du VR de l'ACIA sur demande.
3 - Politiques générales d'échantillonnage
3.1 Procédures de préparation avant l'échantillonnage
Le prélèvement des échantillons doit être effectué par la personne désignée (EDE) dans le protocole écrit de l'établissement relatif à l'échantillonnage microbiologique. Avant de commencer l'échantillonnage, il faut réunir les fournitures d'échantillonnage nécessaires, telles que les gants stériles, les solutions stériles, le savon à main, les solutions désinfectantes, etc., ainsi que le matériel nécessaire à l'échantillonnage de différents types de carcasse (éponges à spécimens en sacs, gabarits pour l'échantillonnage des carcasses de bœuf ou de porc, par exemple).
Lorsqu'on emploie des éponges, une vérification des éponges quant à leur convenance doit avoir été faite (voir également l'addendum 3 procédure 2 Comment préparer l'éponge et le gabarit pour le prélèvement d'échantillons (annexe 2 de la directive 10.250.1 du FSIS (PDF 4 850 ko)) ). Les éponges ne doivent pas avoir de propriétés antimicrobiennes susceptibles de réduire les dénombrements bactériens. Chaque nouveau lot doit être certifié par le fournisseur (par exemple, lettre de garantie) ou doit faire l'objet d'une vérification maison.
De telles vérifications consistent d'ordinaire à immerger une éponge pendant un nombre d'heures dans une solution de transport ensemencée (par exemple, diluant au phosphate de Butterfield) afin de simuler les conditions d'expédition. La solution qui contient un nombre connu de bactéries est ensuite mise en culture afin de vérifier si le nombre de bactéries a diminué de façon importante. Si c'est le cas, cela signifie que l'éponge contient des substances bactéricides.
Pour l'échantillonnage des carcasses de bœuf, de porc et d'équidé, un gabarit est nécessaire pour délimiter la région à échantillonner. Le gabarit peut être fait de métal ou de papier d'aluminium, de papier brun, de plastique souple, etc. Certains gabarits jetables sont stérilisés et préemballés individuellement. Pour fabriquer un gabarit réutilisable pour l'échantillonnage des carcasses de bœuf et de porc, découper un carré de 10 x 10 cm dans une feuille plus grande que la région à échantillonner. (voir la figure 33) Pour l'échantillonnage par épongeage des moutons et des chèvres, le gabarit doit mesurer 10 x 5 cm.
Si un gabarit réutilisable est employé, il est nécessaire de le stériliser avec une solution désinfectante approuvée [une solution d'hypochlorite (eau de javel) ou de l'alcool, p. ex] pour au moins 2 à 3 minutes. Cependant, le gabarit doit être entièrement sec avant d'être appliqué sur la carcasse. Les gabarits de papier d'aluminium ou de papier ne peuvent être utilisés qu'une seule fois; il faut donc les jeter après usage. Le papier d'aluminium utilisé pour la fabrication de gabarits doit être entreposé de manière à prévenir toute contamination. Étant donné que la région délimitée par le gabarit est échantillonnée, il faut prendre soin de ne pas toucher cette région avec autre chose que l'éponge à spécimens. L'utilisation de matériel sale ou contaminé peut mener à des résultats erronés. Si un autoclave est disponible, les gabarits de papier ou de papier d'aluminium peuvent être enroulés dans du papier autoclavable et stérilisés.
Les solutions d'échantillonnage stériles (diluant au phosphate de Butterfield – DPB) peuvent être entreposées à la température ambiante. Toutefois, au moins une journée avant le prélèvement des échantillons, il faut vérifier si les solutions sont limpides. Ne pas utiliser de solutions brouillées, troubles ou renfermant des particules. Placer au réfrigérateur le nombre de contenants de solution d'échantillonnage (DBP) requis pour la prochaine journée d'échantillonnage. S'assurer que les contenants d'expédition, les blocs réfrigérants et les documents d'expédition sont préparés de la façon exigée.
On peut remplacer le diluant au phosphate de Butterfield (DPB) par de l'eau peptonnée tamponnée (EPT) stérile. Il faut savoir cependant que les dénombrements peuvent être légèrement plus élevés lorsqu'on utilise de l'EPT (augmentation de ¼ log). S'il existe des critères de vérification du processus déjà publiés pour la méthode d'échantillonnage, l'on doit toutefois conserver les mêmes valeurs de limite marginale (« m ») et inacceptable (« M »).
3.2 Procédure de sélection aléatoire des carcasses
Les échantillons doivent être prélevés à la fréquence requise.
Les procédures écrites de l'exploitant doivent clairement expliquer la sélection aléatoire des échantillons est obtenue. Chaque carcasse (pour le bœuf, chaque demi-carcasse, par ex., le côté en amont et le côté en aval) doit avoir une chance égale d'être sélectionnée parmi toutes les carcasses/demi-carcasses admissibles. S'il y a des chaînes multiples, choisir de façon aléatoire la chaîne sur laquelle on doit prélever les échantillons pour une période d'échantillonnage donnée. Répéter le processus pour la période d'échantillonnage suivante. Chaque chaîne doit avoir une chance égale d'être choisie à chaque période d'échantillonnage.
Le recours à des tables de nombres aléatoires ou à des systèmes semblables (ordinateur, calculatrice, pige de cartes, etc.) est obligatoire.
Si l'établissement fonctionne avec plusieurs quarts de travail, l'échantillon peut être prélevé durant n'importe quel quart, sous réserve que les exigences susmentionnées (moment, site et carcasse) soient respectées.
3.3 Procédures visant à garantir des techniques d'échantillonnage aseptiques
La présence de micro-organismes de l'environnement, sur les mains, les vêtements, les contenants d'échantillons, les instruments utilisés pour le prélèvement, etc. peut fausser les résultats. Il faut donc avoir des techniques de travail rigoureuses pour effectuer les prélèvements microbiologiques, et il est capital d'utiliser des techniques aseptiques d'échantillonnage ainsi que de l'équipement et des fournitures propres et assainis.
Il devrait y avoir un endroit prévu pour la préparation des fournitures et du matériel nécessaires à l'échantillonnage. Il serait utile d'avoir un chariot ou une table en acier inoxydable muni de roues pour procéder à l'échantillonnage. Un petit chariot ou un panier de manutention pourrait être déplacé jusqu'au site d'échantillonnage et utilisé pour transporter les fournitures, déposer les sacs d'échantillons lorsqu'on ajoute une solution stérile aux sacs d'échantillons, etc.
Le port de gants stériles est requis pour le prélèvement des échantillons. Les seuls articles qui peuvent entrer en contact avec la surface extérieure du gant sont l'échantillon qui est en train d'être prélevé et l'instrument utilisé pour le prélèvement (éponge). Il ne faut pas oublier que les surfaces extérieures du contenant d'échantillon ne sont pas stériles. Il ne faut pas toucher la surface intérieure des contenants d'échantillons stériles. Il ne faut toucher à rien d'autre. On peut utiliser la méthode suivante pour mettre les gants stériles lorsqu'on prélève des échantillons (consulter aussi « La procédure 1 de l'addenda 3 – Enfiler des gants stériles »): Annexe 1 à la directive FSIS 10.250.1 (PDF 4 850 ko).
- ouvrir l'emballage des gants stériles à partir du haut sans contaminer l'extérieur des gants, c'est-à-dire sans les toucher ou respirer sur ceux-ci
- retirer le premier gant de l'emballage en le prenant au niveau de l'ouverture du poignet, par l'intérieur). Éviter tout contact avec l'extérieur du gant. Introduire la main lavée et assainie dans le gant, en prenant soin de ne pas le perforer
- retirer l'autre gant en le prenant au niveau de la manchette, par l'extérieur. Éviter de contaminer l'extérieur du premier gant en tirant sur le second gant pour le mettre. Éviter tout contact des gants avec le visage, la peau, le linge et les autres surfaces non stériles
- si vous pensez que le gant aurait pu être contaminé, le jeter et recommencer à l'étape (1) ci-dessus
3.4 Préparatifs d'échantillonnage
Avant de commencer à prélever des échantillons, il importe de passer en revue les différentes étapes de l'échantillonnage, les méthodes de sélection aléatoire et toute autre information qui vous aidera dans le prélèvement d'échantillons.
La veille du prélèvement des échantillons, après vous être assuré que les solutions stériles ne sont pas troubles, placer le nombre de contenants de DBP dont vous aurez besoin le lendemain dans le réfrigérateur ou la chambre froide. Si les échantillons doivent être expédiés à un laboratoire de l'extérieur, il faut réfrigérer le contenant d'expédition et les blocs réfrigérants.
Le jour de l'échantillonnage, recueillir tous les sacs, les gants stériles, la solution d'assainissement, le savon à mains, les solutions stériles pour l'échantillonnage et le matériel indiqué dans la section (i), Matériel de la partie sur le prélèvement d'échantillons se rapportant au type de carcasses à échantillonner. Il faut s'assurer qu'on a à portée de la main toutes les fournitures nécessaires avant de commencer le prélèvement d'échantillons.
Il faut étiqueter les sacs d'échantillons avant de procéder à l'échantillonnage. Il importe d'utiliser à cette fin de l'encre permanente. Si l'on utilise des étiquettes en papier, il faut apposer celles-ci sur les sacs à la température ambiante, car elles ne colleront pas si elles sont appliquées dans la chambre froide.
Il faut enlever les vêtements extérieurs (blouses, gants, casque protecteur, etc.) portés ailleurs dans l'établissement avant d'entrer dans le lieu où l'on effectuera l'échantillonnage ou de se préparer à prélever les échantillons. Il faut remplacer les vêtements enlevés précédemment par des vêtements propres (par exemple, un sarrau) qui n'ont pas été exposés directement aux parties de l'abattoir qui se trouvent à l'extérieur de l'endroit où l'on effectue l'échantillonnage.
Il faut assainir les surfaces du lieu de travail où l'on effectue à l'échantillonnage en les essuyant avec une serviette en papier propre ou un chiffon jetable qui a été trempé dans une solution contenant 500 ppm (parties par million) d'eau de Javel (0,05 % d'hypochlorite de sodium) ou une autre solution d'assainissement approuvée qui fournit une concentration de chlore disponible équivalente. Il faut essuyer tout liquide qui se trouve sur les surfaces de l'aire de travail avant d'y déposer les fournitures utilisées pour l'échantillonnage et/ou les contenants de produits.
Avant de procéder à l'échantillonnage, il faut se laver et se brosser à fond les mains jusqu'au milieu de l'avant-bras avec un savon bactéricide. Si possible, celui-ci devrait contenir un agent désinfectant offrant l'équivalent de 50 ppm de chlore disponible. Pour s'essuyer les mains, il faut utiliser des serviettes en papier jetables.
Remarque : Veuillez consulter les addendas 2 : Procédures spécifiques de prélèvement d'échantillons et 3 : Il s'agit d'une information technique fournie à titre indicatif en cas de prélèvement d'un micro-organisme - Information technique fournie à titre informatif, selon le cas, pour les lignes directrices sur les procédures de prélèvement spécifiques.
3.5 Procédures d'expédition des échantillons
Si les échantillons doivent être expédiés à l'extérieur, ils doivent être gardés réfrigérés jusqu'au transport et être expédiés réfrigérés au laboratoire qui effectue l'analyse.
Il importe de s'assurer que les échantillons entrent facilement dans les contenants d'expédition afin que les sacs d'échantillons ne soient pas brisés. Il faut utiliser de la façon appropriée les blocs réfrigérants (gel-pack) et bien fermer les contenants d'expédition afin que les échantillons arrivent au laboratoire à une température acceptable. Certaines bactéries peuvent être endommagées par des températures trop froides, tandis que des températures trop chaudes permettront aux bactéries de se multiplier. La conservation des échantillons à des températures inadéquates peut fausser les résultats. Des échantillons congelés ou des échantillons trop chauds (> 10°C) ne sont pas considérés comme valides et ne doivent pas être analysés.
L'échantillon doit être conservé réfrigéré, non congelé, dans le contenant d'expédition avant d'être pris en charge par le service d'expédition. Le contenant d'expédition lui-même ne doit pas être employé comme réfrigérateur. Par contre, on peut placer les échantillons d'une journée dans un contenant d'expédition à découvert si celui-ci est gardé dans une salle réfrigérée ou un réfrigérateur.
La procédure d'emballage suivante peut être utilisée.
- pré-refroidir le contenant d'expédition en plaçant ce dernier à découvert dans un réfrigérateur ale jour précédent l'échantillonnage
- placer l'échantillon, déposé au préalable dans un double-sac correctement étiqueté, dans le contenant pré-refroidi en position debout pour empêcher tout écoulement. Du papier journal peut être utilisé pour caler l'échantillon et le maintenir en position debout. Si plusieurs échantillons sont prélevés pendant une journée, s'assurer que les échantillons sont maintenus à la température de réfrigération requise pour prévenir la multiplication de tout microorganisme présent et pour assurer l'exactitude des résultats
- placer une séparation en carton ondulé sur le dessus des échantillons. Ce carton ondulé vise à prévenir un contact direct entre les blocs réfrigérants et l'échantillon. Ensuite placer un ou des blocs réfrigérants sur le carton ondulé. Utiliser un nombre suffisant de blocs réfrigérants pour maintenir l'échantillon réfrigéré durant son expédition vers le laboratoire. Insérer une bourre en mousse et la compresser pour réduire au minimum l'espace de tête du contenant
- expédier l'échantillon (au moyen de services de livraison ou de messagerie 24 h) au laboratoire désigné
Dans les cas où l'on expédie les échantillons à l'extérieur, la méthode employée pour prévenir la falsification de l'échantillon doit être décrite dans le protocole d'échantillonnage écrit.
4 - Exigences pour les laboratoires
4.1 Laboratoires sur place
Il est possible pour les exploitants d'effectuer leurs propres analyses. Afin d'empêcher la contamination croisée, on recommande de séparer le laboratoire d'analyse microbiologique des aires de fabrication et de limiter l'accès à l'espace de laboratoire. Si l'établissement effectue le dépistage de pathogènes sur les lieux, il devrait mettre en place les mesures de protection supplémentaires suivantes pour garantir la salubrité et la sécurité alimentaires :
- respecter les exigences ayant trait aux travaux de laboratoire de niveau de biosécurité II, tel qu'il est indiqué dans l'ouvrage Biosafety in Microbiological and Biomedical Laboratorie (BMBL) (PDF 3 930 ko) (en anglais seulement)
- limiter l'accès du laboratoire au personnel formé
- s'assurer que le laboratoire fonctionne sous la supervision d'un microbiologiste qualifié ou l'équivalent
On s'attend à ce que les exploitants effectuent leur échantillonnage de manière à ne pas compromettre l'intégrité de l'échantillon ou la fiabilité des résultats d'analyse. Il est possible que les employés de laboratoire de l'établissement disposent d'un exemplaire des procédures de l'AOAC ou d'études publiées dans une revue scientifique évaluée par des pairs décrivant leurs procédures.
Les Guidelines for E. coli Testing for Process Control Verification in Cattle and Swine Slaughter Establishments (PDF 500 ko) (en anglais seulement) proposent les critères ci-après pour les laboratoires. Ces suggestions ne se veulent pas exhaustives. Les besoins particuliers varient d'un exploitant à l'autre.
Personnel
Tant les analystes que les superviseurs de laboratoire doivent avoir suivi des études et une formation en microbiologie alimentaire et posséder une expérience en la matière. Il faut que le personnel connaisse bien les méthodes d'analyse relatives aux échantillons et aux organismes associés aux produits.
Installations
Les laboratoires doivent être adaptés à la réalisation d'analyses microbiologiques régulières et spécialisées et fournir des précautions adéquates en matière de biosécurité. Il est essentiel que le laboratoire demeure séparé, que les aires de réception des échantillons, de préparation et de travail d'analyse soient délimitées.
Équipement
Le laboratoire devrait disposer d'un équipement adéquat, de programmes d'entretien préventif appropriés, de manuels d'équipement facilement accessibles et de registres aux fins de documentation. De l'équipement spécialisé pourrait s'avérer nécessaire pour certaines applications.
Opérations
Le laboratoire devrait disposer d'un programme d'assurance de la qualité (AQ) écrit accessible à tous les employés. Le programme d'AQ doit inclure l'équipement de biosécurité, la préparation de médiums, les méthodes et procédures microbiologiques, les programmes de contrôle, le contrôle de l'équipement, l'entretien des cultures, la réception des échantillons, la manipulation, la déclaration des résultats et la tenue de registres.
Registres
Les registres devraient comporter une description complète des échantillons, y compris la condition, la source, le code du lot, la date, la quantité, etc. Les résultats devraient être déclarés rapidement et toutes les données et les sommaires consignés de façon permanente avec les résultats.
4.2 Laboratoires extérieurs
Les exploitants peuvent opter pour l'analyse des échantillons par un laboratoire externe. Les laboratoires accrédités qui utilisent la ou les méthodes d'analyse acceptées choisies par l'exploitant automatiquement sont réputés satisfaire aux exigences applicables (Liste des laboratoires accrédités par le CCN et la CALA).
4.3 Exigences en matière échantillons
Afin d'obtenir des résultats précis, les échantillons doivent être analysés le plus tôt possible après le prélèvement. Un échantillon doit arriver au laboratoire et être analysé au plus tard le lendemain de son prélèvement. Les laboratoires ne doivent pas analyser les échantillons qui sont congelés ou trop chauds (dont la température est supérieure à 10°C).
Pour assurer l'intégrité des échantillons et le nombre exact de bactéries, les échantillons doivent arriver au laboratoire et leur analyse doit être amorcée dans les 48 heures suivant leur prélèvement. S'il est impossible d'expédier l'échantillon et d'en amorcer l'analyse de laboratoire dans les 48 heures suivant son prélèvement, la carcasse ou le produit choisi aux fins d'échantillonnage doit demeurer réfrigéré, et le prélèvement d'un échantillon ne pourra se faire avant que l'expédition et le début de l'analyse de l'échantillon puissent être effectués dans les 48 heures suivant le prélèvement d'échantillons. Le même principe s'applique aux échantillons qui sont analysés sur place : si l'échantillon ne peut pas être traité aux fins d'analyse dans les 48 heures suivant le prélèvement, la carcasse sélectionnée pour l'échantillonnage doit demeurer réfrigérée et le prélèvement d'échantillon doit être retardé jusqu'à ce que l'échantillon puisse être traité dans les 48 heures suivant le prélèvement. Le FSIS recommande d'inclure la date de prélèvement de l'échantillon et la date à laquelle le laboratoire a commencé à traiter l'échantillon qui sera inclus dans les dossiers de l'établissement.
Il ne faut pas conserver les échantillons prélevés par excision ou par épongeage pendant une période prolongée avant l'analyse. Il faut analyser ces échantillons sur place dans les 48 heures ou les expédier le jour du prélèvement pour que la livraison ait lieu le lendemain au laboratoire qui réalisera l'analyse peu de temps après leur arrivée. Il faut conserver les échantillons prélevés par excision ou par épongeage à basse température, mais non à des températures de congélation, et les expédier dans ces conditions vers le laboratoire dans un contenant d'expédition à isolation comportant des blocs réfrigérants congelés. Enfin, l'identification et la sécurité de tous les échantillons microbiologiques devraient être maintenues pendant l'expédition et l'analyse pour assurer l'intégrité des résultats.
4.4 Méthodes analytiques
Il faut analyser les échantillons en utilisant l'une des méthodes de quantification d'E. coli (biotype I) tirées des Official Methods of Analysis de l'Association of Official Analytical Chemists (AOAC), International, 16e édition, ou toute autre méthode validée par un organisme scientifique dans le cadre d'essais en collaboration à l'aide de la méthode du nombre le plus probable (NPP) à 3 tubes et correspondant aux intervalles de confiance supérieur et inférieur à 95 % de l'indice NPP approprié. Les échantillons pour le E.coli générique seront analysés en utilisant l'une des méthodes de quantification d'E. coli (biotype I) tirées des Official Methods of Analysis de l'AOAC International, 16e édition, 3 Id revision, 1997, ou toute autre méthode validée par un organisme scientifique dans le cadre d'essais en collaboration à l'aide de la méthode du nombre le plus probable (NPP) à 3 tubes et correspondant aux intervalles de confiance supérieur et inférieur à 95 % de l'indice NPP approprié.
L'AOAC a approuvé les méthodes suivantes pour le dénombrement d'E. coli générique dans les aliments :
- méthode NPP à 3-tubes – AOAC 17.2.01 - 17.2.02
- méthode NPP à 3 tubes modifiée – AOAC 17.3.07 – Substrate Supporting Disc Method (ColiComplete®)
- méthode NPP à 3 tubes modifiée – AOAC 17.4.01 – Fluorogenic Assay for Glucuronidase; un bouillon tryptosé au lauryl-sulfate auquel on a ajouté du méthyl-4-umbelliféryl-β-D-glucuronide (MUG) est utilisé pour la méthode NPP à 3 tubes
- méthode sur plaque – AOAC 17.3.04 – Dry Rehydratable Film Method (Petrifilm/numération sur plaque d'E. coli)
- méthode sur plaque/filtration – AOAC 17.3.09 – Membrane filtrante quadrillée hydrophobe/ MUG (ISO-GRID)
Le FSIS a également rendu accessible une liste des trousses de dépistage d'agents pathogènes d'origine alimentaire validées par des organisations indépendantes (PDF 1 784 ko) (en anglais seulement) pour la détection d'agents pathogènes d'origine alimentaire pertinents (par exemple, Salmonella, Campylobacter, E. coli O157:H7 et Listeria spp., y compris L. monocytogenes). Ces listes sont conçues à titre informatif seulement : le fait pour une méthode en particulier de figurer dans cette liste ne constitue ni un soutien ni une approbation à l'endroit de cette méthode.
Remarque : Pour la plupart des épreuves quantitatives, il est possible de limiter au minimum les travaux de laboratoire pendant la fin de semaine en réfrigérant jusqu'au lundi les boîtes et les tubes incubés. Un incubateur programmable réfrigéré est utile dans de tels cas. Pour les méthodes offertes sur le marché, veuillez suivre les recommandations du fabricant.
4.5 Schémas de quantification suggérés
Si l'on utilise une technique générale d'ensemencement de 1 ml sur gélose pour la quantification d'E. coli en vue de l'analyse des échantillons prélevés par épongeage sur les carcasses de bœuf ou de porc, il faut diviser le résultat du dénombrement par 12 afin qu'il corresponde au nombre par cm2. Ceci correspond aux calculs suivants.
Surface épongée : 3 x 100 cm2 = 300 cm2
Quantité de liquide : 10 + 15 ml = 25 ml
Calcul du facteur de conversion : si 25 ml correspond à 300 cm2 alors 1 ml correspond à x cm2 et x = 300 ÷ 25 = 12
Pour tenir compte des valeurs négligeables et inacceptables d'E.coli, (section 6 de la partie I), il faut ensemencer un extrait non dilué de l'échantillon, ainsi que des dilutions de 1:10, 1:100, 1:1 000 et 1:10 000, de préférence en double. Il peut être nécessaire d'ensemencer des dilutions supérieures ou inférieures selon le produit particulier.
Si l'on utilise la technique du filtre quadrillé hydrophobe, il faut filtrer 1 ml de l'extrait non dilué de l'échantillon, et des dilutions de 1:10, 1:100, 1:1 000 et 1:10 000.
Il peut être nécessaire d'utiliser des dilutions supplémentaires de l'extrait original si l'on utilise le protocole du NPP à 3 tubes. On utilise les 3 dilutions les plus fortes qui se sont révélées positives pour E. coli afin de calculer le NPP. Les valeurs du NPP provenant de la table de NPP appropriée représentent le nombre par ml de l'extrait original, et il faut donc les diviser par 12 pour les carcasses de bœuf et porc si l'on veut obtenir le nombre par cm2 de surface de la carcasse.
Le laboratoire fait rapport sur le dénombrement d'E. coli exact. Lorsque les valeurs sont inférieures à 1 cfu/cm2, le dénombrement exact doit être indiqué (par exemple, 0,01 cfu/cm2) – zéro (0) ne doit pas être indiqué comme un résultat. La méthode utilisée pour les carcasses de bœuf et de porc doit avoir une sensibilité minimale de 5 cfu/cm2.
5 - Critères de rendement
Le FSIS a élaboré des critères de rendement relatifs à E. coli de biotype 1 (E. coli de type générique) pour les carasses de bœuf et de porc au moyen de la technique d'échantillonnage par excision (PDF 512 ko) (en anglais seulement). Les critères de rendement sont les chiffres publiés dans les dispositions réglementaires, qui représentent les charges microbiennes les plus élevées attendues sur les carcasses lorsque le procédé d'abattage est bien maîtrisé. Ils offrent des lignes directrices aux abattoirs d'animaux d'élevage ayant trait à l'efficacité de leur procédé d'abattage pour prévenir la contamination fécale. Les résultats d'analyse qui satisfont aux critères des dispositions réglementaires démontrent que l'établissement maintient un contrôle adéquat de ses procédés en ce qui concerne la contamination fécale et les procédures d'habillage hygiénique.
| Types d'animaux d'élevage | Limite inférieure de l'intervalle marginal (m) | Limite supérieure de l'intervalle marginal (M) | Nombre d'échantillons analysés (n) | Nombre maximal permis dans l'intervalle marginal (c) |
|---|---|---|---|---|
| Bovins | Négative Note de tableau a | 100 UFC/cm2 | 13 | 3 |
| Porc Note de tableau b | 10 UFC/cm2 | 10 000 UFC/cm2 | 13 | 3 |
Dans les cas où les critères de rendement de l'United States Department of Agriculture (USDA) n'ont pas été publiés, l'exploitant doit établir des critères pour la surveillance des procédés au moyen de techniques normalisées de contrôle statistique des processus, c'est-à-dire que des techniques de contrôle statistique des procédés seront utilisées pour établir les critères démontrant que leurs activités sont bien maîtrisées.
6 - L'approche de la fenêtre mobile
Le FSIS a utilisé une technique statistique de contrôle des procédés, appelée « approche de la fenêtre mobile » pour établir ses critères ci-haut mentionnés. Les paragraphes suivants expliquent d'une manière simple comment a été conçue l'approche de la fenêtre mobile employée par l'USDA (layman's) et comment elle peut servir à analyser les résultats des tests de dépistage d'E. coli.
6.1 Établissement de "M", "m", "n" et "c"
- des données sont recueillies en vue de l'établissement d'une donnée de référence pour le processus
- les données sont classées depuis le résultat le moins élevé jusqu'au résultat le plus élevé, puis elles sont converties en percentiles i.e., divisées en 100 classes avec des effectifs égaux (contenant un nombre d'unités/individus égaux). Par exemple :
- 1e percentile = première classe de résultats
- 50e percentile = cinquantième classe de résultats (avec cette classe, la valeur médiane est la valeur pour laquelle 50 % des résultats en sont plus petits ou plus grands
- 100e percentile = centième classe de résultats
- le nombre fixé de tests dans la fenêtre mobile (valeur « n ») est établi, et les limites de contrôle sont définies. L'approche de la fenêtre mobile employée par l'USDA utilise un nombre fixé de tests dans la fenêtre mobile, soit « n » = 13, et 2 valeurs limites, soit une valeur absolue de contrôle = « M » et une valeur inférieure de contrôle « m »
- la limite absolue de contrôle (« M ») est la valeur au-delà de laquelle tout résultat se situe, signifiant que le processus n'est plus « sous contrôle », et qu'une action corrective est requise. Selon l'approche de la fenêtre mobile employée par l'USDA, la valeur « M » se situe au 98e percentile des résultats
- la limite inférieure de contrôle (« m ») est une valeur intermédiaire se situant entre la moyenne et la valeur « M ». Les résultats des tests de dépistage qui se situent entre « m » et « M » sont normaux et le processus est encore « sous contrôle ». Cependant, si le nombre de ces résultats dépasse un nombre prédéterminé (valeur « c »), cette tendance veut dire que le processus n'est plus « sous contrôle ». Différentes combinaisons de « m » et de « c » peuvent être utilisées pour évaluer un processus. La sélection de la combinaison à utiliser repose sur des facteurs statistiques (par exemple, niveau de confiance recherché, taille de la population à échantillonner, prévalence du défaut, etc.), et un statisticien est d'ordinaire consulté au moment de la conception du plan d'échantillonnage. L'approche de la fenêtre mobile employée par l'USDA utilise une valeur « c » = 3 et une valeur « m » = 80e percentile
6.2 Utilisation de la fenêtre mobile après que les valeurs "m" et "M" ont été identifiées
- l'exploitant effectue les tests conformément aux exigences prescrites
- les résultats sont consignés au fur et à mesure sur un registre ou sur un diagramme de contrôle
- les résultats sont analysés sur une base continue (chaque fois qu'un résultat est reçu et enregistré)
- au moment de l'analyse des résultats, seuls ceux qui apparaissent dans la fenêtre (c'est-à-dire la dernière valeur « n » des résultats des tests; en l'occurrence les 13 derniers résultats) sont utilisés pour analyser le processus
- si la valeur « M » est dépassée à un moment donné à l'intérieur de la fenêtre mobile (les 13 derniers résultats), on dit que le processus n'est plus « sous contrôle ». Des actions correctives immédiates sont requises dès que la valeur « M » est dépassée
- si la valeur « m » est dépassée plus de 3 fois (valeur « c ») à l'intérieur de la fenêtre mobile (les 13 derniers résultats), on dit que le processus n'est plus « sous contrôle ». Des actions correctives immédiates sont requises dès que cela se produit
- chaque fois qu'un nouveau résultat est reçu, la fenêtre avance de 1 résultat et une analyse est effectuée en fonction des 13 derniers résultats. C'est pourquoi cette méthode est appelée « approche de la fenêtre mobile »
- de façon périodique, à mesure que le processus s'améliore, on peut recalculer les 80e et 98e percentiles et utiliser de nouvelles valeurs « m » et « M »
6.3 Exemple
L'exemple suivant correspond au registre que pourrait tenir un abattoir qui doit faire 2 tests par jour. Les valeurs M et m pour le E. coli (biotype 1) sont établies à 1000 et 100 respectivement, c à 3 fois et n à 13 résultats.
| Test No | Date | Heure | Résultat (cfu/ml) |
Résultat dépassant la limite inacceptable? > (« M ») |
Résultat dépassant la limite marginale? > (« m ») |
Nbre de résultats > m dans les 13 derniers résultats |
Processus « sous contrôle »? (Nbre de résultats > m) = 3 et aucun résultat > M |
|---|---|---|---|---|---|---|---|
| 1 | 10-07 (lundi) | 08:50 | 200 | Non | Oui | 1 | Oui |
| 2 | 10-07 (lundi) | 14:00 | 50 | Non | Non | 1 | Oui |
| 3 | 10-08 (mardi) | 07:10 | 500 | Non | Oui | 2 | Oui |
| 4 | 10-08 (mardi) | 13:00 | 5 | Non | Non | 2 | Oui |
| 5 | 10-09 (mercredi) | 10:00 | 80 | Non | Non | 2 | Oui |
| 6 | 10-09 (mercredi) | 12:20 | 50 | Non | Non | 2 | Oui |
| 7 | 10-10 (jeudi) | 09:20 | 800 | Non | Oui | 3 | Oui |
| 8 | 10-10 (jeudi) | 13:30 | 50 | Non | Non | 3 | Oui |
| 9 | 10-11 (vendredi) | 10:50 | 80 | Non | Non | 3 | Oui |
| 10 | 10-11 (vendredi) | 14:50 | 50 | Non | Non | 3 | Oui |
| 11 | 10-14 (lundi) | 08:40 | 500 | Non | Oui | 4 | Non |
| 12 | 10-14 (lundi) | 12:00 | 80 | Non | Non | 4 | Non |
| 13 | 10-15 (mardi) | 09:30 | 80 | Non | Non | 4 | Non |
| 14 | 10-15 (mardi) | 15:20 | 50 | Non | Non | 3 | Oui |
| 15 | 10-16 (mercredi) | 07:30 | 80 | Non | Non | 3 | Oui |
| 16 | 10-16 (mercredi) | 11:40 | 5 | Non | Non | 2 | Oui |
| 17 | 10-17 (jeudi) | 10:20 | 80 | Non | Non | 2 | Oui |
| 18 | 10-17 (jeudi) | 14:45 | 80 | Non | Non | 2 | Oui |
| 19 | 10-18 (vendredi) | 08:30 | 50 | Non | Non | 2 | Oui |
| 20 | 10-18 (vendredi) | 16:00 | 80 | Non | Non | 2 | Oui |
| 21 | 10-19 (samedi) | 09:10 | 50 | Non | Non | 1 | Oui |
| 22 | 10-19 (samedi) | 13:00 | 1500 | Oui | Oui | 2 | Non |
| 23 | 10-21 (lundi) | 10:30 | 80 | Non | Non | 2 | Oui |
Voici les observations qu'on peut faire à partir de cet exemple.
- le 14 octobre (10-14), à 8 h 40, on observe 4 résultats dépassant la limite marginale (« m ») sur les 11 derniers résultats. Ceci dépasse le nombre maximal de résultats supérieurs à « m » permis (« c » = 3) à l'intérieur du nombre fixé de tests dans la fenêtre mobile (« n » = 13). On dit que le processus n'est plus « sous contrôle »
- la limite de 3 résultats supérieur à « m » sur 13 est également dépassée lors des 2 tests suivants. On dit toujours que le processus n'est plus « sous contrôle », mais étant donné qu'aucun des nouveaux résultats ne dépassent la limite marginale ou inacceptable, la conclusion selon laquelle le processus n'est toujours pas « sous contrôle » ne doit pas être interprétée comme la preuve d'un nouveau problème. Dans le registre ou les documents attestant des actions correctives exécutées après l'identification initiale de la perte de contrôle, on pourra voir si une action a été exécutée pour corriger l'écart
- le 15 octobre (10-15), à 15 h 20, le nombre de résultats supérieurs à la limite marginale (« m ») sur les 13 tests précédents descend à 3 parce que le résultat du 07 octobre (10-07), à 8 h 50, supérieur à « m » sort de la fenêtre lorsque celle-ci avance d'un test. L'on peut maintenant dire que le processus est de nouveau « sous contrôle »
- le 19 octobre (10-19), à 13 h 00, le résultat est supérieur à la valeur limite inacceptable « M ». Même si le nombre de résultats dépassant la limite marginale « m » ne dépasse pas le nombre maximal permis (« c » = 3), on ne peut pas dire que le processus est « sous contrôle ». L'exploitant doit exécuter une action corrective pour corriger l'écart et la consigner dans le dossier prévu à cette fin
- le résultat du 21 octobre (10-021, à 10 h 30, est inférieur à la limite marginale « m ». Le nombre de résultats dépassant la limite marginale « m » est de 2. On peut donc dire que le processus est de nouveau « sous contrôle »
La figure 39 montre les mêmes résultats que l'exemple ci-dessus, mais ceux-ci sont présentés sous une forme graphique. Les nombres qui se trouvent en abscisse (axe des X) correspondent au numéro du test dans l'exemple ci-dessus. De l'information concernant chaque résultat obtenu, comme l'heure et la date du prélèvement de l'échantillon, pourrait aussi être représentée sur le graphique.
7 - Contrôle statistique de procédé
Les techniques de contrôle statistique des procédés (CSP) sont basées sur les principes suivants:
- tout produit émane d'un procédé
- tout procédé est sujet à des variations
- tout procédé peut être compris, décrit et/ou mesuré en termes statistiques ou mathématiques
- le rendement continu d'un procédé peut être évalué si des mesures régulières sont effectuées et si des modifications sont apportées au procédé jusqu'à ce qu'un niveau optimal soit atteint
Selon les principes du CSP, un procédé est dit « sous contrôle » lorsqu'il est stable et performe d'une manière acceptable i.e., les résultats des tests de dépistage se situent près de la moyenne, et restent à l'intérieur des limites établies. Les CSP permettent de détecter des écarts dans le procédé qui ne l'auraient pas été autrement. L'identification rapide des écarts imprévus dans le procédés permet de reconnaître à temps les déficiences et de les corriger.
L'élaboration d'un programme de contrôle statistique du procédé (CSP) comporte initialement une collecte de données dans le but d'établir des paramètres de référence pour le procédé (aussi appelé données de base, niveau de contrôle de procédé). Ces paramètres indiquent ce à quoi correspond un procédé type ou « normal ». Au moyen d'une méthode statistique, la donnée de référence est employée pour établir des critères de vérification du procédé (CVP). Il existe différentes techniques de contrôle statistique du procédé [par exemple, l'approche de la fenêtre mobile, les cartes de contrôle de Shewhart, l'analyse des tendances, les écarts types, les graphiques en fonction du temps (« time plots »), les sommes cumulatives, les diagrammes de contrôle]. Une fois qu'une technique de contrôle statistique du procédé a été sélectionnée et que des CVP ont été établis, une surveillance périodique est menée, et les résultats sont comparés aux CVP pour déterminer si le procédé se situe à l'intérieur des limites « normales ». Si le procédé ne se situe pas à l'intérieur de ces limites, cela indique que celui-ci n'est pas « sous contrôle » et qu'il est temps de chercher et de corriger les causes possibles des résultats anormaux.
Le contrôle statistique des procédés offre aux exploitants un puissant mécanisme de surveillance et d'interprétation des données recueillies pour la surveillance constante de l'Analyse des dangers et maîtrise des contrôles critiques (HACCP). Le contrôle statistique des procédés peut permettre aux exploitants d'obtenir un avertissement précoce si leurs procédés ne fonctionnent pas comme prévu. Cet avertissement peut permettre aux exploitants de prendre des mesures correctives ou d'apporter d'autres modifications à leurs procédés pour regagner la maîtrise de ces derniers sans, en réalité, faire défaut aux critères individuels de rendement déterminés antérieurement.
Ainsi, lorsque l'indicateur microbien choisi est E. coli générique, le contrôle statistique des procédés (CSP) exige que l'exploitant mène une série de dépistages préliminaires d'E. coli de type générique pendant ses propres activités d'abattage et exprime les résultats en UFC/cm2 ou UFC/ml pour déterminer la gamme du nombre de bactéries E. coli de type générique obtenue à l'établissement dans des circonstances normales. Après qu'une entreprise ait recueilli les résultats d'analyse pendant une période suffisamment longue pour estimer qu'elle dispose d'un portrait réel de son rendement, elle établit une limite supérieure et inférieure de contrôle en fonction de ces résultats d'analyse. Il n'existe aucune exigence réglementaire relative à la manière dont sont déterminés les contrôles statistiques des procédés. Les entreprises peuvent utiliser diverses méthodes valides pour déterminer les limites des contrôles statistiques des procédés.
Un exploitant utilisant le contrôle statistique des procédés doit évaluer le rendement historique (normal) du procédé d'abattage lorsqu'il était bien maîtrisé et les critères élaborés qui indiqueront la perte éventuelle du contrôle quant au procédé. L'établissement doit utiliser les résultats de dépistage d'E. coli de type générique (ou un autre organisme faisant l'objet de dépistages, le cas échéant) pour déterminer quand le procédé d'abattage tend vers une perte de contrôle et prendre les mesures nécessaires pour rétablir ce contrôle.
Par exemple, une entreprise peut utiliser la méthode suivante pour mettre sur pied un programme de CSP. L'exploitant :
- effectue une série de dépistages préliminaires d'E. coli de type générique pendant les activités
- exprime les résultats en UFC/cm2
- recueille les résultats d'analyse pendant une période suffisamment longue pour obtenir un portrait fidèle de son rendement (environ 30 jours, habituellement)
- détermine l'intervalle typique du nombre de bactéries E. coli de type générique présentes dans des circonstances normales
- établit une limite supérieure et inférieure de contrôle en fonction des résultats d'analyse
Le lecteur est invité à consulter les ouvrages de référence suivants pour obtenir de plus amples renseignements sur les méthodes statistiques employées pour l'élaboration des CVP.
- Ishikawa, K. 1986 - Guide to Quality control. Kraus International Publications, White Plains, NY
- Kane, V.E. 1989 - Defect Prevention. ASQ Quality Press, Milwaulkee WI
- Kume, H. 1985 - Statistical Methods for Quality Improvement. UNIPUB/Kraus International publications, White Plains, NY
- Surak, J.G. 1999 - SPC for the food processing Industry. Clemson University, Clemson, SC
- Surak, J.G. 1999 - Integrating HACCP and SPC. Clemson University, Clemson, SC
Remarque : Plusieurs des documents susmentionnés ont été élaborés pour des secteurs autres que celui de l'alimentation et comprennent donc des exemples qui peuvent ne pas se prêter à la production alimentaire.
Partie II - Exigences spécifiques d'échantillonnage
1 - Produits et établissements ciblés
Les analyses doivent être réalisées sur les carcasses de tous les abattoirs qui sont admissibles à l'exportation pour toutes les catégories commerciales de bovins, de porcs, de moutons, de chèvres, de chevaux, de mules, d'équidés ou de ratites.
Si une combinaison de types d'animaux d'élevage est abattue, les échantillons sont seulement prélevés de l'espèce abattue en plus grand nombre. Il faut prélever les échantillons d'un seul type d'animaux d'élevage pour déterminer si les contrôles d'habillage hygiénique sont efficaces. Les analyses réalisées permettent de mesurer l'efficacité du procédé, et ce, indépendamment de l'espèce abattue. Cela signifie, par exemple, que si un établissement abat à la fois des porcs des moutons, mais principalement des porcs, les carcasses de porcs doivent faire l'objet de dépistages.
Les établissements sont divisés en 2 catégories : les établissements à très faible volume (TFV) et les établissements à volume supérieur au très faible volume (> TFV). Les catégories d'établissements sont fondées sur le volume annuel d'abattage qui y est effectué.
Les établissements à très faible volume sont décrits ainsi :
- Bovins, chèvres, chevaux ou autres équidés : Abattage annuel de moins de 6 000 têtes
- Porcs : Abattage annuel de moins de 20 000 porcs
- Combinaison de bétail : Abattage annuel inférieur à une combinaison de 6 000 de bovins, auxquels s'ajoutent des moutons, des chèvres, des chevaux ou des équidés, pour un total maximal de 20 000 animaux
- Ratites : Abattage annuel de moins de 6 000 animaux
En ce qui concerne les établissements à TFV, les établissements abattant un nombre supérieur d'animaux aux nombres indiqués ci-dessus sont classés comme établissements dont le volume d'abattage est supérieur au très faible volume.
2 - Prélèvement d'échantillons et fréquences d'échantillonnage
2.1 Indicateur microbien
a) Porc
Les exploitants d'abattoir de porcs doivent déterminer le ou les organismes microbiens qui seront les plus efficaces pour évaluer le contrôle de leur procédé au moment de mettre sur pied un plan d'échantillonnage. La configuration, le procédé, le système de salubrité des aliments en place et les dangers raisonnablement susceptibles de se produire sont uniques à chaque établissement.
Le FSIS recommande qu'un exploitant choisisse au moins un organisme indicateur qui lui permettra d'obtenir des données significatives pour évaluer le contrôle des procédés. Les organismes indicateurs potentiels sont notamment les colonies bactériennes aérobies (CBA), Enterobacteriaceae (EB), E. coli de type générique et le nombre total de coliformes. Le FSIS recommande aux exploitants d'utiliser les CBA, car ils sont moins spécifiques que E. coli de type générique et offrent des données plus quantifiables. Le dénombrement permet à un établissement de tracer ces données sur un diagramme de contrôle des procédés et de surveiller les tendances dans ces données et procédés au fil du temps. Plus grand est le nombre de données microbiologiques quantifiables accessibles pour un établissement, plus il est possible pour ce dernier de bien évaluer puis de contrôler les variations présentes dans son procédé (Williams, 2015). En revanche, les bactéries E. coli de type générique constituent un plus petit groupe (un sous-ensemble) de la famille des bactéries Enterobacteriaceae; l'analyse d'échantillons de dépistage de E. coli de type générique entraîne souvent des résultats non détectables (valeurs nulles), et pour cette raison il est difficile pour un établissement de détecter des changements dans la charge microbienne à différents points de son procédé, et de déterminer les tendances en matière de données pour prendre des décisions sur le contrôle de procédé.
Les exploitants d'établissements à TFV assujettis à l'inspection traditionnelle peuvent choisir de poursuivre les analyses de dépistage d'E. coli de type générique pour satisfaire aux exigences d'échantillonnage du FSIS. Le FSIS considère que les exigences en vertu d'anciennes dispositions réglementaires pour le dépistage d'E. coli de type générique chez le porc sont une « règle refuge » pour l'évaluation du contrôle des procédés.
Les anciennes dispositions que le FSIS estime faire partie intégrante de cette règle refuge sont les suivantes :
- Pour la réalisation de tests de dépistage d'E. coli de type générique, le FSIS exige qu'un établissement prélève une série de 13 échantillons, au minimum, afin de pouvoir évaluer le contrôle des procédés
- La cueillette de l'échantillon nécessite que l'établissement effectue un prélèvement par excision ou écouvillon sur la fesse, le flanc et la bajoue de la carcasse à la fin du procédé de refroidissement. Les lignes directrices du FSIS : Les lignes directrices pour les tests d'Escherichia coli pour la vérification du contrôle des processus dans les établissements d'abattage de bovins et de porcins fournissent des directives plus détaillées sur les procédures d'échantillonnageignes directrices (Guidelines for Escherichia coli Testing for Process Control Verification in Cattle and Swine Slaughter Establishments provides more detailed guidance on the sampling procedures (PDF 512 ko) (en anglais seulement)
- Les laboratoires analysant les échantillons doivent utiliser une méthode quantitative pour l'analyse de dépistage d'E. coli de type générique qui est approuvée et publiée : 1) comme méthode officielle de l'Association of Official Analytical Chemists (AOAC) (AOAC internationale) ou 2) par un organisme scientifique fondé sur les résultats d'essais collaboratifs réalisés conformément à un protocole reconnu internationalement et comparé à la méthode du nombre le plus probable (NPP) à 3 tubes; ce type de méthode doit également correspondre aux intervalles de confiance supérieur et inférieur à 95 % de l'indice NPP approprié (9 CFR 310.25(a)(3))
Remarque : Pour obtenir de plus amples renseignements sur les nouvelles exigences, il est possible de consulter les lignes directrices du FSIS à FSIS Guideline: Modernization of Swine Slaughter Inspection Developing Microbiological Sampling Programs in Swine Slaughter Establishments September 2019 (PDF 1 162 ko) (en anglais seulement)
b) Bétail autre que le porc et les ratites
Les analyses de dépistage d'E. coli de biotype 1 doivent être réalisées sur les carcasses dans tous les abattoirs qui sont admissibles à l'exportation pour toutes les catégories commerciales de bovins, de moutons, de chèvres, de chevaux, de mules, d'équidés ou de ratites.
2.2 Lieu
Le lieu renvoie à l'endroit où l'échantillon est prélevé dans l'établissement.
a) Porc
Les exploitants doivent analyser un échantillon prélevé sur une carcasse avant l'éviscération et un autre échantillon sur une carcasse après le refroidissement pour chaque événement d'échantillonnage; il n'est pas nécessaire que ces échantillons proviennent de la même carcasse. « Après le refroidissement » renvoie à un point subséquent dans le procédé d'abattage, après que les carcasses ont été refroidies et que toutes les interventions ont été appliquées avant la fabrication. Il convient de noter que, à la suite de l'application d'un antimicrobien avant le point de prélèvement d'un échantillon, un temps d'égouttement d'au moins 60 secondes devrait être observé pour réduire le transfert involontaire d'antimicrobiens dans l'échantillon prélevé.
Pour les opérations de désossage à chaud les échantillons sont prélevés après le lavage final, avant le désossage.
Les exploitants d'établissements à TFV assujettis à l'inspection traditionnelle peuvent choisir de poursuivre les analyses de dépistage d'E. coli de type générique après le refroidissement seulement pour satisfaire aux exigences d'échantillonnage du FSIS.
b) Bétail autre que le porc et les ratites
Les échantillons de bétail sont recueillis après avoir été réfrigérés pendant une période minimale de 12 heures. Aucune limite de temps maximale n'est établie. Il est possible de sélectionner les carcasses pendant qu'elles sont sur le rail ou après le lavage final et de les mettre de côté dans un endroit commode de la chambre froide aux fins d'analyse après la réfrigération. Il est acceptable de sélectionner des échantillons aléatoires avant l'entrée des carcasses dans la chambre froide.
Les échantillons de ratites sont prélevés à la fin de la chaîne de refroidissement ou d'égouttage ou au dernier point accessible avant l'emballage ou le découpage.
Pour les opérations de désossage à chaud les échantillons sont prélevés après le lavage final, avant le désossage.
2.3 Sites et méthode d'échantillonnage
Le site d'échantillonnage renvoie aux endroits sur la carcasse où des échantillons sont recueillis. Pour prélever des échantillons d'E. coli de type générique, 2 méthodes d'échantillonnage peuvent être utilisées par un établissement.
- Excision
- Épongeage
L'échantillonnage par excision consiste à couper de façon aseptique une section à la surface de la carcasse de l'animal d'élevage et à envoyer l'échantillon de tissu à un laboratoire aux fins d'analyse. L'épongeage consiste à effectuer l'écouvillonnage de la surface de la carcasse d'un animal d'élevage ou d'un ratite au moyen d'une éponge stérile et à l'envoyer ensuite vers le laboratoire aux fins d'analyse (veuillez consulter les addendas 1, 2, 3 et 4 pour obtenir des détails sur les sites et techniques d'échantillonnage).
Remarque : Pour les ratites, l'exploitant doit recueillir des échantillons de ratites entiers à la fin du procédé de refroidissement. Les échantillons provenant de ratites peuvent être prélevés par épongeage sur le dos et la cuisse de la carcasse ou par rinçage de la carcasse entière selon une quantité de solution tampon appropriée pour ce type d'oiseau.
2.4 Fréquence
La fréquence de l'échantillonnage est fondée sur le volume de production de l'établissement (voir l'addenda 1 : Tableau récapitulatif d'échantillonnage pour obtenir un sommaire de dépistage pour le bétail et les ratites).
-
Les établissements à très faible volume commencent l'échantillonnage pendant la première semaine complète d'activité après le 1er juin. Ils continuent de recueillir au moins un échantillon par semaine pendant chaque semaine d'activité jusqu'à ce que 13 échantillons aient été prélevés. La série de 13 analyses doit montrer le contrôle de procédé avant que la série puisse prendre fin. Si la 13e analyse indique que le procédé d'habillage hygiénique est hors de contrôle, l'établissement doit continuer à effectuer des analyses jusqu'à ce que le contrôle des procédés soit rétabli.
Les 13 échantillons ne doivent pas être prélevés en une seule journée ni même en une seule semaine. L'échantillonnage s'étalant sur une certaine période donne une meilleure idée du contrôle des procédés de l'établissement que le prélèvement de tous les échantillons en même temps.
Les exploitations saisonnières à TFV doivent terminer toutes les épreuves de dépistage d'E. coli pendant les mois d'activités. Par exemple, un abattoir de chèvres saisonnier menant ses activités de septembre à décembre doit commencer à effectuer des analyses pendant sa première semaine complète d'activités et effectuer 13 analyses avant la fin des activités en décembre.
Lorsqu'un établissement à TFV ayant réalisé 13 analyses pour l'année effectue des modifications, comme le remaniement des lieux, l'ajout d'un nouvel équipement, de nouveaux employés ou de nouvelles procédures qui ont une incidence sur le bon fonctionnement des mesures de contrôle des procédés, il est nécessaire de réaliser des analyses hebdomadaires jusqu'à ce qu'une autre série de 13 analyses puissent établir l'efficacité du procédé modifié. Si l'ACIA détermine que des changements ont eu lieu qui touchent les mesures de contrôle des procédés, les renseignements doivent être fournis par écrit à l'entreprise. L'établissement est ensuite tenu de poursuivre le dépistage d'E. coli pour évaluer le contrôle des procédés.
-
Les établissements dont le volume d'abattage est supérieur au très faible volume effectuent des analyses de dépistage aux fréquences suivantes.
Bovins, moutons, chèvres, chevaux ou équidés : un dépistage pour 300 carcasses. Porc : un dépistage pour 1 000 carcasses; ratites : un dépistage pour 3 000 carcasses.
Les établissements dont le volume d'abattage est supérieur au très faible volume doivent prélever des échantillons aux fréquences indiquées ci-dessus ou au moins une fois par semaine, et choisir, des deux, la fréquence supérieure. Par exemple, un établissement qui abat 9 000 bovins par année doit prélever un échantillon une fois par semaine (un total de 52 échantillons par année), et non seulement 30 échantillons par année comme il est indiqué par la fréquence d'un dépistage pour 300 carcasses (30 échantillons fois 300 carcasses est égal à 9 000 carcasses).
Le volume d'abattage ne correspond pas toujours aux taux de fréquence indiqués dans les dispositions réglementaires. Les établissements devraient tenir compte du volume d'abattage supplémentaire. Cela peut être réalisé en effectuant des analyses de dépistage supplémentaires. Par exemple, un établissement d'abattage de porcs qui abat 1 500 porcs par jour devrait effectuer un dépistage au moins une fois par jour, selon la fréquence d'un dépistage pour 1 000 carcasses. Or, il faut également tenir compte des 500 carcasses restantes pour surveiller le contrôle des procédés. En vue de tenir compte du volume supplémentaire d'abattage, l'établissement pourrait « reporter » les 500 autres carcasses au volume de la journée suivante et réaliser 2 dépistages la deuxième journée.
2.5 Sélection aléatoire des carcasses
Pour les bovins, chaque demi-carcasse représente un entité admissible à l'échantillonnage. Autant le côté en amont que le côté en aval doit avoir une chance égale d'être sélectionnée lors d'une période d'échantillonnage donnée. Pour les autres espèces de bétail, la carcasse constitue l'entité admissible à l'échantillonnage.
Pour s'assurer que toutes les carcasses ont une chance égale d'être choisies, le programme doit mettre l'emphase sur :
- la détermination au hasard du moment d'échantillonnage soit déterminé au hasard (on peut également choisir au hasard un numéro séquentiel de carcasse)
Remarque : La sélection des carcasses (ou des demi-carcasses) peut être effectuée avant que la carcasse n'entre dans la salle de refroidissement. La carcasse sélectionnée peut être étiquetée et placée dans les salles de refroidissement avec d'autres carcasses et dirigée vers le site de prélèvement d'échantillons après 12 heures de réfrigération (lorsque des méthodes de réfrigération conventionnelles sont utilisées). Les carcasses ne doivent pas être placées dans une zone spéciale en début de réfrigération, car cela pourrait fausser les conditions réelles de réfrigération de la carcasse.
- la détermination au hasard de l'endroit de prélèvement des échantillons doit être déterminé au hasard (s'il y a plusieurs sites possibles) Par exemple : Dans le cas de carcasses de bœuf, de porc, de mouton, de chèvre et d'équidé à sélectionner à l'intérieur des chambres froides (12 heures ou plus après l'abattage), sur des chaînes de classement ou sur toute autre chaîne : il faut choisir au hasard la chambre froide et l'emplacement à l'intérieur de la chambre froide où une carcasse doit être échantillonnée pour la période d'échantillonnage (par exemple, une journée de production); il faut aussi choisir au hasard la demi-carcasse ou le côté de carcasse à échantillonner.
- après avoir identifié la demi-carcasse ou la carcasse sélectionnée au hasard à partir du point d'échantillonnage temps/endroit déterminé, compter à rebours 5 demi-carcasses/carcasses et sélectionner la demi-carcasse/carcasse qui suit pour l'échantillonnage. Chaque demi-carcasse/carcasse doit avoir une chance égale d'être sélectionnée. En comptant à rebours 5 demi-carcasses, on évite tout biais possible au moment de la sélection
Si l'établissement fonctionne avec plusieurs quarts de travail, l'échantillon peut être prélevé durant n'importe quel quart, sous réserve que sous réserve que les exigences susmentionnées (moment, site et carcasse) soient respectées.
Veuillez consulter les addendum 2 : Procédures spécifiques de prélèvement d'échantillons, selon le cas pour les lignes directrices sur les procédures d'échantillonnage spécifiques.
3 - Présentation et interprétation des résultats
3.1 Registre des résultats de dépistage
a) Porc
Les techniques précises de contrôle statistique des procédés sont, notamment, l'utilisation d'un diagramme de contrôle qui non seulement trace les données en fonction du temps, mais présente également une limite supérieure de contrôle pour des mesures précises et, souvent, une ligne centrale, au-dessus et en dessous de laquelle on peut s'attendre à un nombre approximativement égal de résultats d'échantillons, puisque la ligne centrale est fondée sur l'historique d'échantillonnage antérieur. Un résultat d'échantillonnage au-dessus de la limite supérieure de contrôle indiquerait la présence probable d'une cause spéciale de variation à laquelle il faut donner suite. Les résultats demeurant dans les limites de contrôle indiquent simplement que le procédé est bien maîtrisé.
Les diagrammes de contrôle sont utilisés pour :
- Analyser et comprendre les variables qui ont une incidence sur le procédé
- Déterminer les capacités des procédés
- Évaluer les effets des variables sur la différence entre le rendement ciblé et le rendement réel
Les résultats d'analyse de dépistage doivent être tracés et évalués dans une série en fonction du temps. Le diagramme des résultats de dépistage devrait être mis à jour à intervalle régulier, idéalement le jour ouvrable après le compte rendu des résultats par le laboratoire d'analyse. Chaque fois qu'un nouveau résultat d'analyse de dépistage est consigné, le plus ancien de la série devrait être retiré de la fenêtre mobile. Par exemple, il est possible pour un établissement de choisir d'évaluer ses résultats de dépistage dans une fenêtre mobile de 13 dépistages. L'établissement utiliserait cette série de 13 dépistages pour évaluer son contrôle de procédé pendant une période représentée par une série de 13 dépistages. Le diagramme de contrôle serait mis à jour au moyen de chaque nouveau résultat d'analyse déclaré, ce qui ajouterait le nouveau résultat en question et retirerait le plus ancien résultat du diagramme.
L'analyse microbiologique offre une mesure de l'étendue du contrôle à l'étape faisant l'objet de l'évaluation et aux étapes précédentes. En effectuant des analyses microbiologiques à différents points d'un procédé, il est relativement facile de déterminer un segment du procédé où il y a perte de contrôle. En outre, la vérification de l'habillage hygiénique et l'analyse de dépistage des produits finis (bien que non requises) peuvent fournir une mesure intégrée du rendement du procédé dans sa totalité. Les résultats de dépistage avant l'éviscération et après le refroidissement pourraient être tracés dans le même diagramme au moyen de limites supérieures de contrôle distinctes et correspondantes pour mieux établir la corrélation entre les échantillons et calculer la réduction en logs entre les 2 échantillons.
b) Bétail autre que le porc et les ratites
Les résultats de dépistage d'E. coli de type générique sont présentés en tant que quantité ou concentration bactérienne. La concentration bactérienne peut être exprimée au moyen de méthodes d'analyse de laboratoire fondées sur l'unité formant des colonies (UFC) ou le nombre le plus probable (NPP) pour évaluer le dépistage des souches d'E. coli de type générique.
L'exploitant utilisant les critères « m » et « M » doit enregistrer chaque résultat de dépistage exprimé en unités formant des colonies par centimètre carré (UFC/cm2) pour les excisions. En revanche, un exploitant recourant à la méthode de contrôle statistique du procédé (CSP) peut exprimer les résultats en tant qu'UFC/cm2 ou NPP/cm2 (échantillons par épongeage).
L'exploitant doit consigner les résultats sur un diagramme de contrôle du procédé ou un tableau qui indique au moins les 13 résultats de dépistage les plus récents. Les registres des tableaux et les diagrammes (voir l'exemple de la figure 39) comportant les résultats de dépistage d'E. coli de type générique doivent être conservés pendant 12 mois.
On doit indiquer la date et l'heure du prélèvement des échantillons et, s'il y a plus d'une chaîne d'abattage, la chaîne sur laquelle l'échantillon a été prélevé.
3.2 Critères d'évaluation des résultats de dépistage
a) Porc
Les critères de rendement sont ceux qui représentent les charges microbiennes les plus élevées attendues sur les carcasses lorsque le procédé d'abattage est bien maîtrisé. Les résultats de référence quant au dépistage d'E. coli de type générique (au moyen de la technique d'échantillonnage par écouvillonnage des surfaces) peuvent aider les établissements qui abattent des porcs à évaluer l'efficacité de leur procédé au moyen de leurs propres résultats de dépistage ((Generic E. coli 8058) (en anglais seulement)).
Un établissement peut également choisir d'utiliser les critères de rendement relatifs au dépistage d'E. coli de type générique définis dans le texte Guidelines for Escherichia coli Testing for Process Control Verification in Cattle and Swine Slaughter Establishments (PDF 1 468 ko) (en anglais seulement), (veuillez consulter la section 5 de la partie I) pour les échantillons recueillis au moyen d'une méthode de collecte par excision. Ces critères de rendement relatifs au dépistage d'E. coli de type générique ont été séparés en 3 catégories pour la vérification du contrôle des procédés : acceptable, marginale et inacceptable. Un établissement est réputé fonctionner dans le respect des critères quand le résultat de dépistage d'E. coli de type générique ne dépasse pas la limite supérieure (M), et lorsque 3 échantillons ou moins sur les 13 échantillons (n) prélevés obtiennent des résultats positifs à des niveaux supérieurs (m).
Étant donné que chaque établissement d'abattage de porcs décidera du ou des organismes microbiens les plus efficaces pour évaluer le contrôle de ses procédés au moment de mettre sur pied un plan d'échantillonnage, d'autres limites supérieures d'un organisme indicateur sont fournies dans le tableau ci-dessous. Les limites supérieures de contrôle dans le tableau ont été déterminées à partir d'échantillons par écouvillonnage des surfaces, en fonction de l'étude de référence du FSIS sur le porc de marché (MHBS), et peuvent être utilisées pour toutes les espèces porcines, mais les exploitants ne sont pas tenus d'utiliser ce tableau. Il existe une certaine variabilité d'une catégorie de porcs à l'autre. L'information présentée dans le tableau ci-dessous représente la limite au 80e centile pour les autres organismes indicateurs. Les centiles représentent le pourcentage d'établissements se situant sous le nombre associé dans la distribution des indicateurs bactériologiques par établissement.
| Organisme indicateur | CBA | Enterobacteriaceae | Nombre total de coliformes | E. coli | ||||
|---|---|---|---|---|---|---|---|---|
| Moyenne UFC/cm2 | Avant l'éviscération | Après le refroidissement | Avant l'éviscération | Après le refroidissement | Avant l'éviscération | Après le refroidissement | Avant l'éviscération | Après le refroidissement |
| 4 200 000 | 790 | 8 300 | 110 | 5 500 | 35 | 3 800 | 30 | |
| Centile de distribution | 80 % | 80 % | 80 % | 80 % | ||||
Nationwide Microbiological Baseline Data Collection Program: Market Hogs Survey (en anglais seulement).
Un exploitant devrait viser des résultats sous les limites indiquées pour l'organisme indicateur sélectionné aux lieux situés avant l'éviscération et après le refroidissement. Les résultats de l'organisme indicateur situés sous la limite supérieure de contrôle indiqués dans le tableau ci-dessus montrent que le procédé est bien maîtrisé. Le FSIS recommande à l'exploitant de tracer ses données sur un diagramme de contrôle afin d'évaluer ses résultats de dépistage au fil du temps et d'évaluer le contrôle et la variabilité des procédés dans son système de salubrité des aliments. En outre, le FSIS recommande que les exploitants surveillent la réduction en logs avant l'éviscération et après le refroidissement comme mesure supplémentaire pour évaluer le contrôle des procédés.
Exemple
Si un exploitant obtient des résultats de dépistage de CBA supérieurs à 790 UFC/cm2 après le refroidissement, il est fort probable que son procédé est hors de contrôle et que l'exploitant doive prendre des mesures correctives pour reprendre le contrôle de son procédé (Compliance Guideline for Controlling Salmonella in Market Hogs (en anglais seulement))
Un exploitant devrait évaluer ses données d'échantillonnage à une fréquence prédéfinie et ajuster ses limites supérieures de contrôle afin d'abaisser les seuils pour tenir compte des tendances améliorées quant au contrôle des procédés. On ne conseille pas aux exploitants d'élever leurs limites supérieures de contrôle en réponse aux tendances à la hausse dans les données d'échantillonnage, puisque leurs limites supérieures de contrôle ont été calculées à l'origine en fonction du fait que leurs procédés étaient bien maîtrisés.
b) Bétail autre que le porc et les ratites
- Utilisation des critères de rendement (valeurs m/M) pour évaluer les résultats de dépistage (se référer à la section V de la partie 1)
On compare les résultats de dépistage d'E. coli aux critères réglementaires et on peut les classer en 3 catégories : acceptable, marginale (représenté par « m ») et inacceptable (représenté par « M »). Les résultats marginaux (« m ») sont ceux qui se classent dans la tranche de 20 % des pires rendements de l'industrie en ce qui concerne le nombre de bactéries E. coli (résultats tirés d'une étude de référence). Plus de 3 résultats marginaux dans les 13 derniers dépistages est inacceptable. Les résultats se situant dans la tranche de 2 % des pires rendements de l'industrie dans son ensemble (résultats tirés de l'étude de référence) correspondent à la valeur maximale ou « M ». Chaque résultat de dépistage dépassant « M » est inacceptable. Les valeurs m et M sont appliquées à une fenêtre mobile des 13 derniers résultats de dépistage documentés. Cela signifie que l'établissement consulte les 13 derniers résultats au moment de déterminer si le procédé est bien maîtrisé. Chaque fois qu'un nouveau résultat de dépistage est ajouté aux registres, le plus ancien résultat est retiré et le nouveau résultat devient le plus récent des 13 plus récents résultats.
En ce qui concerne le procédé d'abattage dont on veut évaluer le contrôle, un nombre maximal de 3 résultats d'échantillon peuvent être situés au-dessus de la ligne marginale « m ». Si 4 résultats se situent au-dessus de « m », le procédé est hors de contrôle.
Si le résultat de dépistage du plus récent échantillon est supérieur à « M », le procédé est automatiquement hors de contrôle, et ce, indépendamment des résultats de dépistage antérieurs. Dès qu'un autre résultat de dépistage est consigné dans le diagramme ou le tableau, le dépistage « M » devient simplement un autre résultat considéré comme étant supérieur à la ligne « m ». Cela n'entraîne plus comme conséquence la défaillance « automatique » du contrôle des procédés.
Après que le procédé d'abattage a été jugé être hors de contrôle, un résultat de dépistage ultérieur sous la ligne « m » indique que l'établissement a pris des mesures pour corriger un problème et reprendre le contrôle du procédé. Or, le procédé n'est pas considéré être entièrement maîtrisé jusqu'à ce que la fenêtre de 13 dépistages indique qu'il y a contrôle du procédé.
On peut par exemple utiliser le tableau en examinant un établissement d'abattage de bovins qui utilise la méthode d'échantillonnage par excision. Voici le résultat de dépistage d'E. coli :
- acceptable s'il s'avère négatif
- marginal si le résultat de dépistage est positif, mais inférieur à 100 UFC/cm2
- inacceptable s'il se situe au-dessus de 100 UFC/cm2
On trouvera dans la section VI de la partie 1 un exemple de méthode que les exploitants peuvent utiliser pour la tenue de registre.
Une autre méthode que l'entreprise peut utiliser consiste à documenter ses résultats de dépistage d'E. coli dans un diagramme de contrôle. Les résultats de dépistage sont tracés sur un diagramme (veuillez consulter l'exemple de diagramme de contrôle à la figure 39).
- Utiliser un contrôle statistique du procédé (CSP) pour évaluer les résultats de dépistage
En l'absence des critères de rendement mentionnés ci-dessus, l'exploitant doit utiliser un contrôle statistique du procédé (CSP) pour établir les critères à utiliser pour évaluer et documenter les résultats de dépistage d'E. coli de type générique. Tant que les points de données dans le diagramme de l'entreprise ne dépassent pas les limites de contrôle établies par l'exploitant, le procédé est réputé être bien maîtrisé.
Les résultats en matière de bactérie E. coli de type générique publiés dans l'avis du Federal Register publié le 17 décembre 2005 peut compléter le CSP en offrant aux exploitants une mesure supplémentaire pour évaluer le contrôle des procédés.
Les résultats ci-dessous concernent les carcasses de bovins à partir desquels des échantillons ont été prélevés au moyen de la méthode par épongeage.
| Produit | Méthode | 80e centile | 98e centile |
|---|---|---|---|
| Carcasses de bovins | Épongeage | 0,0 UFC/cm2 | 3,1 UFC/cm2 |
3.3 Mesures en réponse à la perte de contrôle des procédés
Dans le cadre de ses procédures de contrôle des procédés, un exploitant doit définir les mesures qu'il prendra si les résultats de dépistage obtenus dépassent la limite établie. L'exploitant doit définir les mesures qu'il prendra, les personnes qui prendront chacune de ces mesures, la manière dont le résultat de ces mesures sera consigné et la façon dont les mesures seront vérifiées.
Si un exploitant détermine que les résultats de dépistage tendent à indiquer une perte de contrôle des procédés, il devrait prendre des mesures pour chercher la ou les causes profondes. Un exploitant devrait examiner la manière dont les différentes parties de son système de salubrité des aliments fonctionnent ensemble et la façon dont elles influencent le système de salubrité des aliments en entier. Pour ce faire, les exploitants doivent évaluer leurs procédures de contrôle des procédés, leurs pratiques en matière d'habillage hygiénique et leurs procédures d'assainissement pour déterminer si la ou les causes profondes peuvent être cernées et, par la suite, prendre des mesures afin de corriger le problème. Cette évaluation devrait inclure l'examen des registres de surveillance des procédés de l'exploitant et de ses procédés pendant les activités normales. L'exploitant devrait tenir compte de tous les problèmes de mise en œuvre éprouvés et des modifications apportées aux procédés ou aux pratiques, comme les procédures d'habillage hygiénique, y compris, notamment :
- Les procédures de nettoyage et d'assainissement routiniers de l'équipement, y compris les outils manuels utilisés pour éliminer la contamination ou pour pratiquer des incisions sur la carcasse; la conception, la configuration et l'étalonnage de l'équipement pour en assurer le fonctionnement adéquat en fonction des paramètres opérationnels pour empêcher le contact entre les carcasses et les pièces et prévenir la contamination des carcasses
- Les pratiques des employés en matière d'hygiène, comme le fait de s'assurer que les employés nettoient fréquemment leurs mains, l'équipement, les ustensiles et les tabliers qui entrent en contact avec les carcasses, et que les employés sont adéquatement formés lorsqu'il y a de nouveaux employés ou des remplaçants dans la chaîne
- La mise en œuvre de traitements d'intervention antimicrobiens ou mécaniques, comme le lavage des carcasses, les pulvérisateurs ou les brosses, conformément aux limites choisies et soutenues par l'établissement, y compris une application efficace pour assurer la couverture de la carcasse entière
À la suite de son enquête, l'exploitant doit donner suite à ses conclusions en déployant les procédures adéquates de décontamination et les traitements d'intervention antimicrobiens, au besoin, pour remédier à la contamination s'étant possiblement produite sur les carcasses ou les pièces. L'exploitant devrait également prendre des mesures pour amorcer la réparation ou l'étalonnage de son équipement et la formation d'employés, au besoin, en fonction des causes profondes de la perte de contrôle des procédés ayant été déterminées.
Le FSIS a également rendu accessibles les Compliance Guideline for Controlling Salmonella in Market Hogs (PDF 1 149 ko) (en anglais seulement). Les lignes directrices résument les points de contrôle éventuels relatifs à Salmonella dans le procédé de production avant et après l'abattage. Les exploitants devraient utiliser ce guide pour améliorer leurs pratiques de gestion, afin d'assurer des procédures d'habillage hygiénique efficaces et d'aider à enquêter sur les événements de perte apparente de contrôle des procédés. Lorsqu'un exploitant apporte des modifications aux endroits appropriés de son procédé, le contrôle de ce dernier devrait s'améliorer et entraîner la production de produits de porc cru dans des paramètres acceptables, y compris les organismes indicateurs et Salmonella.
Partie III - Activités de vérification et mesures d'application de Agence canadienne d'inspection des aliments
1 - Activités de vérification
En principe, les exigences du FSIS correspondent à l'élaboration, la mise en œuvre et l'entretien, par l'exploitant, d'un programme d'échantillonnage et de dépistage, tel qu'il est indiqué dans la présente annexe. Il appartient également à l'exploitant d'élaborer et de mettre en œuvre un plan d'action à la satisfaction du vétérinaire responsable de l'ACIA (VR) à la réception de résultats dépassant les limites que prévoient les critères de surveillance du procédé, ce qui indique la perte du contrôle relatif au procédé.
Les inspecteurs de l'ACIA vérifieront que les établissements répondent aux exigences applicables en matière de dépistage, c'est-à-dire qu'ils examineront le programme d'échantillonnage et de dépistage aux fins de vérification pour confirmer qu'il satisfait aux exigences applicables et en surveiller la mise en œuvre; si les résultats d'analyse indiquent une possible perte de contrôle du procédé, les inspecteurs s'assureront que l'exploitant a pris ou prend les mesures correctives nécessaires pour rétablir le contrôle des procédés.
Les observations suivantes indiquent le non-respect des exigences réglementaires du FSIS relatives au dépistage.
- L'exploitant n'effectue pas l'échantillonnage microbiologique au lieu requis ou à la fréquence requise en fonction de la taille et du volume de production de l'établissement
- L'exploitant n'emploie pas la technique requise d'échantillonnage ou n'effectue pas l'échantillonnage aux sites requis sur la carcasse
- L'intégrité des échantillons, par exemple, le caractère aléatoire et la manipulation des échantillons, n'est pas maintenue
- Le laboratoire n'utilise pas une méthode quantitative d'analyse approuvée comme la méthode officielle de l'AOAC International ou une méthode approuvée et publiée par un organisme scientifique
Les registres ne sont pas accessibles à l'ACIA ou non conservés pendant 12 mois
2 - Mesures de mise en application
2.1 Manque de conformité relatif aux critères de rendement quant au contrôle des procédés
Les critères de rendement sont des lignes directrices, non pas des normes réglementaires. Les résultats de dépistage indiquant un manque de contrôle des procédés devraient être examinés de pair avec d'autres renseignements, comme la mise en œuvre efficace par l'exploitant de systèmes de HACCP pour s'assurer que les animaux destinés à l'alimentation sont abattus dans des conditions hygiéniques; déterminer si la tendance globale des conclusions de l'inspection donne à penser que l'établissement n'entretient pas des conditions hygiéniques d'un bout à l'autre du système HACCP d'abattage. Par exemple, un exploitant présente à répétition, des cas de non-conformité en matière de HACCP ou d'exigences préalables en ce qui concerne différents aspects du système d'abattage, ou les mesures correctives de l'exploitant, en réponse aux constats de contamination fécale visible, sont constamment inefficaces : cela peut indiquer la présence de problèmes systématiques quant au système HACCP d'abattage. D'autres mesures d'application de la loi peuvent s'avérer nécessaires si, à répétition, l'établissement ne procède pas à la mise en œuvre de mesures immédiates appropriées ou d'autres mesures prévues pour donner suite au constat de non-conformité. Le VR devrait discuter avec son superviseur immédiat quant à la nécessité de prendre des mesures d'application de la loi.
2.2 Manque de conformité en matière d'exigences réglementaires relatives au dépistage
En ce qui concerne le non-respect des exigences du FSIS ayant trait à l'élaboration, à la mise en œuvre et à l'entretien d'un programme de surveillance microbiologique d'échantillonnage et de dépistage, si l'exploitant ne présente aucun plan d'action correctif pour régler la situation, le VR doit aviser le vétérinaire spécialiste aux opérations, exportation des viandes, ou son remplaçant des procédures à entreprendre pour retirer l'établissement de la liste des établissements admissibles à l'exportation vers les États-Unis.
Addenda 1 - Tableau sommaire sur le dépistage
| Espèce | Fréquence de dépistage | Lieu de dépistage | Point d'échantillonnage | Méthode d'échantillonnage |
|---|---|---|---|---|
| Bovins | 1 carcasse sur 300 ou 1 par semaine (choisir la fréquence supérieure) | Réfrigération des carcasses : plus de 12 heures Désossage à chaud : après le dernier lavage |
Flanc, poitrine, croupe | Excision Note de tableau c Épongeage |
| Abattoir de porcs à TFV régi en fonction d'inspections traditionnelles | 1 carcasse sur 1000 ou 1 par semaine (choisir la fréquence supérieure) | Réfrigération des carcasses : plus de 12 heures Désossage à chaud : après le dernier lavage |
Flanc, fesse, bajoue | Excision Note de tableau c Épongeage |
| Porc (tous les autres) | S.O. | 1 échantillon avant et 1 échantillon après la réfrigération par événement d'échantillonnage (il n'est pas nécessaire que les échantillons soient prélevés de la même carcasse) | S.O. | S.O. |
| Mouton et chèvre | 1 carcasse sur 300 ou 1 par semaine (choisir la fréquence supérieure) | Carcasses refroidies et désossées à chaud : après le dernier lavage | Flanc, poitrine, croupe | Épongeage |
| Carcasses avec la peau | 1 carcasse sur 300 ou 1 par semaine (choisir la fréquence supérieure) | Carcasses refroidies | Flanc intérieur, poitrine intérieure, croupe intérieure | Épongeage |
| Équidés | 1 carcasse sur 300 ou 1 par semaine (choisir la fréquence supérieure) | Carcasses refroidies et désossées à chaud : après le dernier lavage | Flanc, poitrine, croupe | Épongeage |
| Ratites | 1 carcasse sur 300 ou 1 par semaine (choisir la fréquence supérieure) | Carcasses refroidies et désossées à chaud : après le dernier lavage | Épongeage du dos et de la cuisse | Épongeage |
Addenda 2 - Procédures spécifiques de prélèvement d'échantillons
Les procédures d'échantillonnage de l'exploitant doivent être décrites en détail par écrit. Les procédures qui suivent sont tirées des lignes directrices (PDF 500 ko) (en anglais seulement) publiées par le FSIS. Les établissements qui procèdent au dépistage d'E. coli sur le bœuf ou le porc doivent utiliser la technique d'échantillonnage par excision ou la technique d'échantillonnage par épongeage décrite dans la présente section; ceux qui procèdent au dépistage d'E. coli sur le mouton, la chèvre ou les équidés doivent utiliser la technique d'échantillonnage par épongeage décrite dans la présente section et pour les ratites élaborer des procédures de prélèvement en se basant sur les lignes directrices fournies dans cette section.
D'autres méthodes d'échantillonnage (par exemple, une excision au lieu d'un épongeage) peuvent être utilisées, à la condition qu'elles aient été évaluées par l'ACIA et trouvées acceptables. Les établissements qui souhaitent utiliser d'autres méthodes d'échantillonnage doivent soumettre leur proposition au Centre opérationnel d'orientation et d'expertise (COOE) – Importation et Exportation des Aliments, qui acheminera leur proposition à la Division de l'Importation et de l'Exportation des Aliments (DIEA).
2.1 Méthode d'excision
Les lignes directrices pour les tests d'Escherichia coli pour la vérification du contrôle des processus dans les abattoirs de bovins et de porc (PDF 500 ko) (en anglais seulement) doivent être employée lorsque les critères de rendement fournies à la section V de la Partie 1 sont appliqués.
2.2 Procédures de prélèvement d'échantillons de carcasse (bovins, ovins, caprins, équins) - Méthode par épongeage
Matériel
- éponge à spécimens stérile dans un sac à languettes métalliques, ou l'équivalent
- 25 ml de diluant au phosphate de Butterfield (DPB stérile)
- sac stérile de type auto-scellant (ziplock) en plastique, sac pour stomacher, ou l'équivalent
- gabarit pour une zone de prélèvement de 100 cm2 (sauf pour le mouton et la chèvre pour lesquels un gabarit de 50 cm2 est requis)
- gants stériles
- échelle montée sur roues, plate-forme d'échantillonnage ou escabeau
- solution d'assainissement
- petit chariot ou panier de manutention pour le transport des fournitures
Prélèvement
Lire la section sur les « Politiques générales d'échantillonnage »
Utiliser une éponge à spécimens (ces éponges sont habituellement vendues déshydratées et pré-emballées dans un sac stérile) pour prélever les 3 échantillons sur la carcasse (flanc, poitrine et croupe – voir l'addenda 4, figures 2 and 2a)). Il importe d'éponger les régions à échantillonner en commençant par les moins contaminées pour éviter de propager toute contamination. Il faut donc éponger les régions dans l'ordre indiqué dans le présent protocole d'échantillonnage.
L'échantillonnage superficiel non destructif doit être exécuté de la façon suivante (veuillez aussi consulter la procédure 3 de l'addenda 3 « Éponger une carcasse de bœuf »).
- Veiller à ce que tous les sacs aient été pré-étiquetés et à ce que toutes les fournitures se trouvent à portée de la main, notamment le gabarit d'échantillonnage. (Il serait utile de pouvoir compter sur un assistant pendant le processus d'échantillonnage.)
- Si l'on utilise un gabarit réutilisable, il faut l'immerger dans une solution d'assainissement approuvée pendant au moins une à 2 minutes. Juste avant d'éponger la première région à échantillonner sur la carcasse (étape 13), retirer le gabarit de la solution. Secouer tout surplus de solution de l'instrument et prendre garde de ne pas contaminer la partie du gabarit qui sera en contact avec la carcasse
- Repérer les régions à échantillonner sur le flanc, la poitrine et la croupe à l'aide des illustrations et des instructions présentées à la figure 34 (zones d'échantillonnage sur la carcasse de bœuf)
- Placer l'échelle, la plate-forme ou l'escabeau près de la carcasse de manière à ce que la zone à échantillonner sur la croupe (figure 34 de l'addenda 4) soit facilement accessible à partir de l'échelle
- Tout en tenant le sac contenant l'éponge par la languette, déchirer la bande perforée transparente qui se trouve à la partie supérieure du sac
- Enlever le bouchon de la bouteille de DPB stérile, tout en prenant soin de ne pas toucher le goulot
- Verser soigneusement environ la moitié du contenu de la bouteille de DPB stérile (environ 10 ml) dans le sac afin d'humecter l'éponge
- Refermer le sac en ramenant les 2 languettes ensemble. Avec les mains, appliquer de la pression à l'extérieur du sac et pétrir doucement l'éponge jusqu'à ce qu'elle soit Complètement hydratée (humectée)
- En laissant le sac fermé, pousser doucement l'éponge humectée vers la partie supérieure du sac en ramenant une extrémité étroite de l'éponge vers l'ouverture du sac. Il ne faut pas ouvrir le sac ou toucher l'éponge avec les doigts. Tout en tenant le sac, retirer tout surplus de liquide de l'éponge en la pressant avec les mains de l'extérieur du sac. L'éponge doit encore se trouver complètement à l'intérieur du sac
- Ouvrir le sac contenant l'éponge en prenant soin de ne pas toucher la surface intérieure du sac avec les doigts. La languette en métal qui se trouve à la partie supérieure du sac devrait maintenir le sac ouvert. Mettre le sac de côté
- Mettre une paire de gants stériles (Veuillez consulter la procédure 1 de l'addenda 3 « Enfiler des gants stériles »)
- Retirer délicatement l'éponge humectée du sac avec le pouce, l'index et le majeur de la main utilisée pour effectuer le prélèvement
- Avec l'autre main, saisir l'extrémité extérieure du gabarit en prenant soin de ne pas contaminer les bords intérieurs qui délimitent la zone d'échantillonnage
- Repérer la zone à échantillonner sur le flanc. Placer le gabarit sur cette zone
- Maintenir le gabarit en place avec une main gantée (il ne faut pas oublier que seule l'éponge doit toucher la zone à échantillonner. Il faut prendre soin de ne pas contaminer cette région avec les mains.)
- Avec l'autre main, passer l'éponge sur la zone délimitée par le gabarit (10 x 10 cm) environ 10 fois à la verticale et 10 fois à l'horizontale. La pression à appliquer correspond à celle que vous exerceriez pour essuyer du sang séché sur la carcasse. Il faut cependant éviter d'appuyer trop fort afin de ne pas abîmer l'éponge. (Nota : Il peut être nécessaire de faire basculer le gabarit d'un côté à l'autre pendant l'épongeage étant donné que la surface de la carcasse n'est pas plane. Cela permet de s'assurer que la région épongée correspond à 100 cm2.)
- Répéter les étapes 14 à 16 pour la région de la poitrine en utilisant la même face de l'éponge que celle utilisée pour essuyer la région du flanc
- Après avoir épongé la poitrine, prendre le gabarit avec la main qui tient l'éponge. Il faut éviter de contaminer l'éponge ou les bords intérieurs du gabarit
- Monter dans l'échelle ou sur la plate-forme en tenant la rampe avec la main utilisée pour tenir le gabarit. Une fois à la hauteur nécessaire pour échantillonner la croupe, reprendre le gabarit dans la main utilisée pour tenir la rampe en veillant à ne pas contaminer les bords intérieurs du gabarit
- Répéter les étapes 14 à 16 pour la région de la croupe en utilisant la face « propre » de l'éponge (c.-à-d., le côté qui n'a pas été utilisé préalablement pour éponger les régions du flanc et de la poitrine)
- Après avoir essuyé la région de la croupe, replacer soigneusement l'éponge dans le sac en prenant soin de ne pas toucher l'extérieur du sac avec celle-ci
- Redescendre l'échelle en tenant la rampe
- Verser le restant du DPB (environ 15 ml) dans le sac contenant l'échantillon afin que le volume total soit d'environ 25 ml
- Évacuer le surplus d'air du sac et replier le rebord supérieur de celui-ci 3 ou 4 fois afin de le refermer. Pour maintenir le sac fermé, il faut replier les languettes contre le sac. Placer le sac fermé dans un deuxième sac et bien refermer celui-ci
-
- Si les échantillons sont analysés dans un laboratoire sur place : commencer à les préparer pour analyse
- Si les échantillons doivent être expédiées à l'extérieur : suivre les procédures d'expéditions
- Les résultats doivent être analysés selon les critères établis au moyen de la technique de contrôle statistique de procédés propres à l'établissement – la fenêtre mobile et les critères de vérification du processus pré-établis (« m » et « M ») Ne peuvent être employés
2.3 Procédures de prélèvement d'échantillons de carcasse de porcs - Méthode par épongeage – Porc
Matériel
- Éponge à spécimens stérile dans un sac stérile à languettes métalliques, ou l'équivalent
- 25 ml de diluant au phosphate de Butterfield (DPB stérile)
- Sac stérile de type auto-scellant (Ziplock) en plastique, sac pour Stomacher, ou l'équivalent
- Gabarit pour une zone de prélèvement de 100 cm2
- Gants stériles
- Échelle montée sur roues, plate-forme d'échantillonnage ou escabeau
- Solution d'assainissement
- Petit chariot ou panier de manutention pour le transport des fournitures
Prélèvement
Lire la section III de la partie 1 sur les « Politiques générales d'échantillonnage ».
Utiliser une éponge à spécimens (ces éponges sont habituellement vendues déshydratées et pré-emballées dans un sac stérile) pour prélever les 3 échantillons sur la carcasse (flanc, fesse et bajoue – voir les figures 37 et 38). Il importe d'essuyer les régions à échantillonner en commençant par les moins contaminées afin d'éviter de propager toute contamination. Il faut donc essuyer les régions dans l'ordre indiqué dans le présent protocole d'échantillonnage. L'échantillonnage superficiel non destructif doit être exécuté de la façon suivante (veuillez aussi consulter la procédure 4 de l'addenda 3 « Épongeage d'une carcasse de porc ») :
- Veiller à ce que toutes les fournitures se trouvent à portée de la main. (Il serait utile de pouvoir compter sur un assistant pendant le processus d'échantillonnage.)
- Si l'on utilise un gabarit réutilisable, il faut l'immerger dans une solution d'assainissement approuvée pendant au moins une à 2 minutes. Juste avant d'essuyer la première région à échantillonner sur la carcasse (étape 12), retirer le gabarit de la solution. Secouer tout surplus de solution de l'instrument et prendre garde de ne pas contaminer la partie du gabarit qui sera en contact avec la carcasse
- Repérer les régions à échantillonner sur le flanc, la fesse et la bajoue à l'aide des illustrations et des instructions présentées aux figures 37 et 38 (zones d'échantillonnage sur la carcasse de porc)
- Placer l'échelle, la plate-forme ou l'escabeau près de la carcasse de manière que la zone à échantillonner sur la fesse (figures 37 et 38) soit facilement accessible à partir de l'échelle
- Tout en tenant le sac contenant l'éponge par la languette, déchirer la bande perforée transparente qui se trouve à la partie supérieure du sac et ouvrir le sac
- Enlever le bouchon de la bouteille de DPB stérile, tout en prenant soin de ne pas toucher le goulot. Prendre garde de ne pas contaminer le bouchon
- Verser soigneusement environ la moitié du contenu de la bouteille de DPB stérile (environ 10 ml) dans le sac afin d'humecter l'éponge. Remettre le bouchon sur la bouteille de DPB
- Refermer le sac en ramenant les 2 languettes ensemble. Avec les mains, appliquer de la pression à l'extérieur du sac et pétrir doucement l'éponge jusqu'à ce qu'elle soit Complètement hydratée (humectée)
- En laissant le sac fermé, pousser doucement l'éponge humectée vers la partie supérieure du sac en ramenant une extrémité étroite de l'éponge vers l'ouverture du sac. Il ne faut pas ouvrir le sac ou toucher l'éponge avec les doigts. Tout en tenant le sac, retirer tout surplus de liquide de l'éponge en la pressant avec les mains de l'extérieur du sac. L'éponge doit encore se trouver complètement à l'intérieur du sac
- Ouvrir le sac en prenant soin de ne pas toucher la surface intérieure de celui-ci avec les doigts. La languette en métal qui se trouve à la partie supérieure du sac devrait maintenir le sac ouvert
- Mettre une paire de gants stériles (consulter aussi la procédure 1 de l'addenda 3 « Enfiler des gants stériles »)
- Retirer délicatement l'éponge humectée du sac avec le pouce, l'index et le majeur de la main que vous utiliserez pour effectuer le prélèvement
- Avec l'autre main, saisir l'extrémité extérieure du gabarit en prenant soin de ne pas contaminer les bords intérieurs qui délimitent la zone d'échantillonnage
- Repérer la zone à échantillonner sur la poitrine. Placer le gabarit sur cette zone
- Maintenir le gabarit en place avec une main gantée (il ne faut pas oublier que seule l'éponge doit toucher la zone à échantillonner. Il faut prendre soin de ne pas contaminer cette région avec les mains)
- Avec l'autre main, passer l'éponge sur la zone délimitée par le gabarit (10 x 10 cm) environ 10 fois à la verticale et 10 fois à l'horizontale. La pression à appliquer correspond à celle que vous exerceriez pour essuyer du sang séché sur la carcasse. Il faut cependant éviter d'appuyer trop fort afin de ne pas abîmer l'éponge
Remarque : Il peut être nécessaire de faire basculer le gabarit d'un côté à l'autre pendant l'épongeage étant donné que la surface de la carcasse n'est pas plane. Cela permet de s'assurer que la région épongée correspond à 100 cm2.) - "Après avoir essuyé la poitrine, prendre le gabarit avec la main qui tient l'éponge tout en prenant soin de ne pas contaminer l'éponge ni les bords intérieurs du gabarit délimitant la zone d'échantillonnage
- Monter dans l'échelle ou sur la plate-forme en tenant la rampe avec la main utilisée pour tenir le gabarit. Une fois à la hauteur nécessaire pour échantillonner la fesse, reprendre le gabarit dans la main utilisée pour tenir la rampe en veillant à ne pas contaminer l'éponge, ni les bords intérieurs du gabarit
- Répéter les étapes 14 à 16 pour la région de la fesse en utilisant la même face de l'éponge que celle utilisée pour essuyer la région de la poitrine
- Après avoir essuyé la région de la fesse, prendre le gabarit avec la main qui tient l'éponge. Il faut éviter de contaminer l'éponge ou les rebords intérieurs du gabarit
- Redescendre l'échelle en tenant la rampe
- Reprendre le gabarit dans la main utilisée pour tenir la rampe en veillant à ne pas contaminer l'éponge ni les bords intérieurs du gabarit
- Répéter les étapes 14 à 16 pour la région de la bajoue en utilisant la face « propre » de l'éponge (c.-à-d., le côté qui n'a pas été utilisé préalablement pour éponger les régions du flanc et de la fesse)
- Après avoir essuyé la région de la bajoue, replacer soigneusement l'éponge dans le sac en prenant soin de ne pas toucher l'extérieur du sac avec celle-ci
- Verser le restant du DPB (environ 15 ml) dans le sac contenant l'échantillon afin que le volume total soit de 25 ml
- Évacuer le surplus d'air qui se trouve dans le sac contenant l'éponge et replier le rebord supérieur 3 ou 4 fois afin de le refermer. Pour maintenir le sac fermé, il faut replier les languettes contre le sac. Placer le sac dans un deuxième sac et bien refermer celui-ci
-
- Si les échantillons sont analysés dans un laboratoire sur place : commencer à les préparer pour analyse
- Si les échantillons doivent être expédiées à l'extérieur : suivre les procédures d'expéditions
- Les résultats doivent être analysés selon les critères établis au moyen de la technique de contrôle statistique de procédés propres à l'établissement – la fenêtre mobile et les critères de vérification du processus pré-établis (« m » et « M ») Ne peuvent être employés
Addenda 3 - Il s'agit d'une information technique fournie à titre indicatif en cas de prélèvement d'un micro-organisme.
Cette information technique est tirée de la directive originale 10.250.1 du FSIS.
Lignes directrices du FSIS en matière de procédures d'échantillonnage pour le dépistage de micro-organisme - Information technique fournie à titre informatif)
- Enfiler des gants stériles
- Préparer l'éponge et le gabarit pour le prélèvement de l'échantillon
- Épongeage d'une carcasse de bœuf
- Épongeage d'une carcasse de porc
3.1 Enfiler des gants stériles
Étape 1
Premièrement, laver et désinfecter vos mains jusqu'aux avant-bras. Sécher vos mains au moyen de serviettes en papier jetables.
Placer l'emballage des gants de sorte que les lettres « L » et « R » se trouvent face à vous (« L » = gauche; « R » = droite)
Étape 2
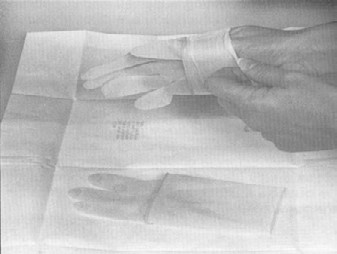
Lorsque vous ouvrez l'emballage, les gants sont pliés, ils forment un revers de manche et sont placés la paume vers le haut. Laisser les gants dans l'emballage jusqu'à ce que vous commenciez à les enfiler.
Étape 3
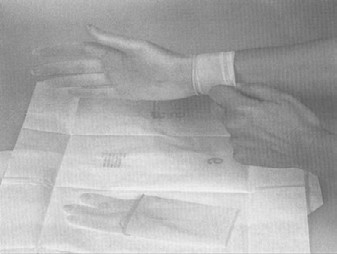
Ouvrir 1 gant en le tenant par le revers. Introduire votre main dans le gant, la paume vers le haut, et retirer le gant de l'emballage.
Étape 4

Enfiler le gant complètement en tirant le revers au moyen de l'autre main sans toucher la surface externe du gant.
Étape 5

Répéter les étapes précédentes avec l'autre gant, avec 1 seule différence importante : ne pas manipuler le second gant en le tenant par le revers. Si vous le faites, l'extérieur du premier gant stérile risque d'entrer en contact avec votre main et votre poignet au moment d'enfiler le second gant. Même si vous avez lavé et désinfecté vos mains, elles ne sont pas stériles. La bonne façon de faire est de placer votre main nue, la paume vers le haut, dans le second gant.
Insérer les doigts de votre main gantée dans le pli du deuxième revers et faciliter la mise en place du second gant.
Étape 6

Manipuler le second gant par l'extérieur seulement et ajuster le revers sur votre poignet.
Étape 7

Dès que les 2 gants sont enfilés, vous pouvez toucher l'extérieur d'un gant avec l'autre main gantée pour l'ajuster.
Si, à quelque moment que ce soit, vous pensez que le gant pourrait être contaminé, le jeter et recommencer la procédure pour enfiler des gants stériles.
3.2 Préparer l'éponge et le gabarit pour le prélèvement d'échantillons
Étape 1

Il faut effectuer ces étapes immédiatement avant de prélever l'échantillon par épongeage.
Se laver les mains et les sécher.
Retirer le contenant d'eau peptonée tamponnée (EPT) du réfrigérateur.
Étape 2
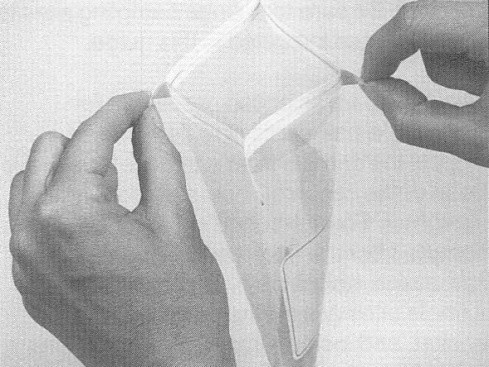
Ouvrir le sac contenant l'éponge en le tenant par la languette métallique de l'ouverture (habituellement colorée en blanc ou en jaune). Déchirer la bande perforée transparente qui se trouve à la partie supérieure du sac et ouvrir le sac. Ne pas retirer ou briser les languettes métalliques.
Séparer les 2 petites languettes blanches de chaque côté du sac pour ouvrir l'embouchure du sac.
Étape 3
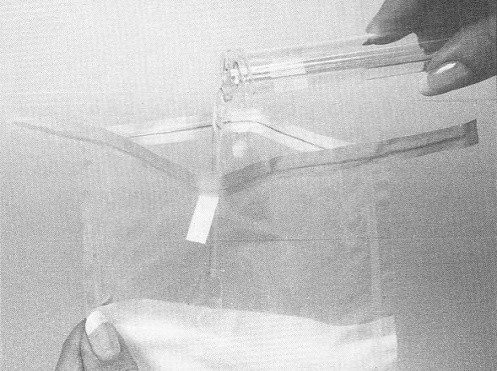
Enlever le couvercle du contenant d'EPT stérile et préalablement refroidi tout en prenant soin de ne pas en toucher l'ouverture.
Verser soigneusement tout le contenu du contenant d'EPT stérile (10 ml) dans le sac afin d'humecter l'éponge. Mettre le contenant de côté.
Étape 4
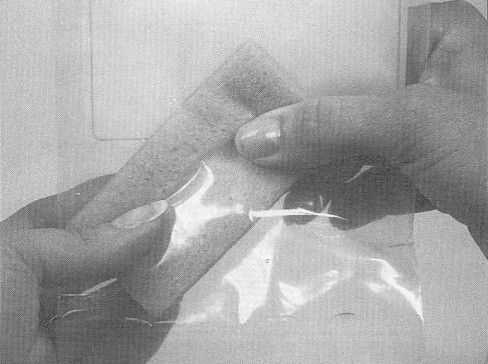
Appuyer sur les languettes métalliques pour les joindre et fermer la partie supérieure du sac à éponge.
Exercer une pression manuelle sur le sac afin de masser soigneusement l'éponge jusqu'à ce qu'elle soit complètement humectée.
Étape 5

En laissant le sac fermé, pousser doucement l'éponge humectée vers la partie supérieure du sac.
Placer une extrémité de la largeur de l'éponge vers l'ouverture du sac.
Étape 6
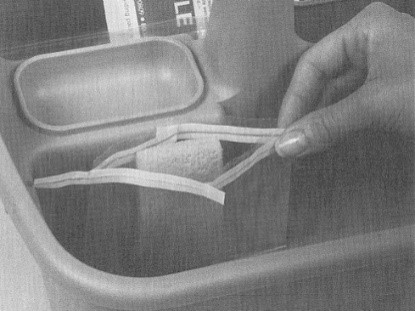
Ouvrir le sac en prenant soin de ne pas toucher la surface intérieure de celui-ci avec les doigts. La languette métallique qui se trouve à la partie supérieure du sac devrait maintenir le sac ouvert.
Mettre le sac de côté en prenant soin de ne pas contaminer l'éponge.
Étape 7

Ouvrir le sac du gabarit en tenant le sac par 1 coin et déchirer la bande perforée transparente qui se trouve à la partie supérieure du sac.
Mettre le sac de côté en prenant soin de ne pas contaminer le gabarit.
Étape 8
Enfiler une paire de gants stériles en suivant les instructions de la procédure 1 – Enfiler une paire de gants stériles.
Retirer délicatement l'éponge humectée du sac en la prenant par l'extrémité avec votre main gantée, celle que vous utiliserez pour faire le prélèvement. Éviter de toucher l'extérieur du sac.
Avec l'autre main gantée, saisir l'extrémité extérieure du gabarit en prenant soin de ne pas contaminer les bords intérieurs qui délimitent la zone d'échantillonnage.
Effectuer le prélèvement d'échantillon par épongeage pour l'espèce en particulier.
3.3 Éponger une carcasse de bœuf
Objet de cette annexe
La méthodologie est fournie ici pour usage dans des projets spéciaux ou d'autres situations où elle pourrait être requise
Préparation pour la collecte d'un échantillon
- Sélectionner un moment pour le prélèvement de l'échantillon. Déterminer les moments où des carcasses refroidies pendant au moins 12 heures seront accessibles. Choisir ensuite au hasard un moment dans ce délai pour le prélèvement des échantillons
- Sélectionner le lieu le plus froid à partir duquel prélever l'échantillon. Sélectionner un lieu sécuritaire et accessible dans la chambre froide pour prélever des échantillons à partir d'une demi-carcasse de bœuf. Ce lieu peut être situé sur la chaîne de transfert, la chaîne de classement, dans une rampe, ou un endroit dégagé dans la chambre froide
- Utiliser les techniques aseptiques telles qu'elles sont indiquées au chapitre III, section 3 de la Partie 1.
- se laver et se désinfecter les mains
- désinfecter les surfaces de travail (surfaces qui entreront en contact avec les fournitures au moment de les rassembler)
- rassembler les fournitures
- étiqueter le sac à éponge
- se laver et se désinfecter les mains
- apporter les fournitures au lieu d'échantillonnage
- désinfecter les surfaces de travail (surfaces qui entreront en contact avec les fournitures pendant l'échantillonnage)
- étendre des serviettes absorbantes ou une grille désinfectée sur la surface de travail pour empêcher la carcasse de glisser
Prélever l'échantillon (par épongeage)
- Au moment aléatoire déterminé, se rendre au lieu d'échantillonnage. Ne pas choisir la carcasse située au lieu déterminé préalablement. Compter plutôt 5 unités en aval ou en amont puis choisir la sixième unité aux fins d'échantillonnage. (n comptant 5 demi-carcasses en aval ou en amont, on évite tout biais possible au moment de la sélection). Normalement, il n'est pas nécessaire que l'établissement déplace un grand nombre de demi-carcasses pour en trouver une aléatoirement aux fins d'échantillonnage
- Éponger la carcasse et préparer l'envoi de l'échantillon (suivre les techniques d'épongeage décrites à la procédure 2 – Préparer l'éponge et le gabarit en vue de la collecte d'échantillons) :
- Placer l'équipement (penser à la salubrité)
- Situer les zones sur la carcasse pour l'échantillonnage (voir la section Points d'échantillonnage pour le dépistage sur les carcasses de bœuf)
- Disposer les fournitures
- Ouvrir le sac à éponge
- Verser de l'EPT dans le sac à éponge
- Fermer le sac et masser l'éponge
- Pousser l'éponge vers la partie supérieure du sac, ouvrir le sac et le placer sur une surface désinfectée
- Ouvrir le sac du gabarit et le placer sur une surface désinfectée
- Enfiler les gants stériles (voir la procédure 1 – Enfiler une paire de gants stériles)
- Retirer l'éponge
- Retirer le gabarit
- Appliquer le gabarit sur le flanc. Ne pas toucher à la zone d'échantillonnage
- Tenir le gabarit avec une main gantée et utiliser l'autre main pour passer l'éponge sur la zone
- Effectuer 10 frottis verticaux sur toute la surface d'échantillonnage, puis 10 frottis horizontaux sur toute la surface d'échantillonnage
- Appliquer le gabarit sur la poitrine. Ne pas toucher à la zone d'échantillonnage
- Tenir le gabarit avec une main gantée et utiliser l'autre main pour passer l'éponge sur la zone
- Effectuer 10 frottis verticaux sur toute la surface d'échantillonnage, puis 10 frottis horizontaux sur toute la surface d'échantillonnage
- Grimper avec prudence pour effectuer l'échantillonnage de la croupe tout en empêchant le gabarit ou l'éponge de toucher à toute autre zone ne faisant pas l'objet de l'échantillonnage
- Appliquer le gabarit sur la croupe. Ne pas toucher à la zone d'échantillonnage
- Tenir le gabarit avec une main gantée et utiliser l'autre main pour passer l'éponge sur la zone
- Effectuer 10 frottis verticaux sur toute la surface d'échantillonnage, puis 10 frottis horizontaux sur toute la surface d'échantillonnage
- Placer l'éponge dans le sac Whirl-Pak® et sceller le sac
- L'échantillon est maintenant complet. Suivre les consignes d'entreposage et d'expédition
Sites d'échantillonnage pour le dépistage sur la croupe de carcasses de bœuf
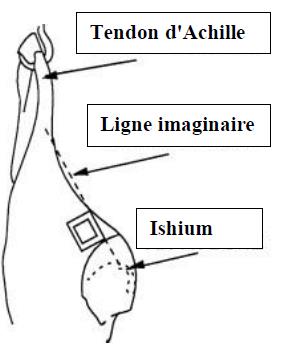
Localiser la face postérieure de l'ischium ou os pubien. Tracer une ligne imaginaire jusqu'au tendon d'Achille. À l'intersection de la ligne avec la surface de découpe de la ronde se trouve le point de départ pour l'échantillon de la croupe.
Placer le gabarit sur cette zone de la croupe.
Note : Cette illustration a été modifiée : une vue latérale véritable de la carcasse ne permettrait pas de voir l'os pubien. À partir d'une vue médiale, on ne pourrait pas voir dans sa totalité la zone d'échantillonnage de 10 cm sur 10 cm. Par conséquent, une vue latérale affichant le retrait d'une partie de la ronde est indiquée pour illustrer l'emplacement de l'os pubien.
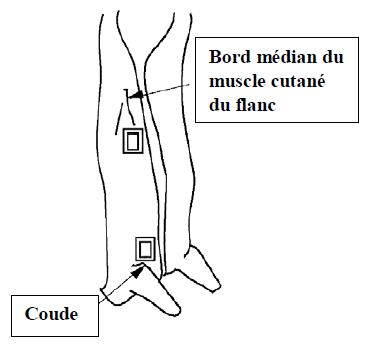
Flanc
Localiser le muscle du flanc cutané (oblique abdominal externe) et suivre la bordure médiale du muscle (Medial border of cutaneous flank muscle) antérieurement jusqu'à environ 3 pouces de la ligne médiane.
Voilà où positionner le gabarit.
Poitrine
Localiser le coude (Elbow) de la carcasse. Tracer une ligne imaginaire tout droit (en position médiane) jusqu'à la découpe médiane.
Voilà où positionner le gabarit.
Technique d'échantillonnage à l'épongeage d'une carcasse de bœuf
Étape 1

Fournitures d'échantillonnage comprises dans le contenant d'expédition :
- 1 – éponge à spécimens stérile dans un sac Whirl-Pak®
- 1 – 10 ml d'eau peptonnée tamponnée (EPT) stérile et antérieurement refroidie
- 1 – gabarit stérile dans un sac
- 1 – paire de gants stériles
- 1 – pochette en plastique de 6 pouces sur 12 pouces pour le formulaire d'échantillonnage dûment rempli
- 1 – formulaire du FSIS 7355-2A/2B Trousse de sceau de sécurité pour échantillon de laboratoire
- 3 – timbres pré-imprimés et facturables FedEx (un pour chacun des laboratoires du FSIS)
- 1 – tampon absorbant
- 1 – bourre en mousse par contenant d'expédition et séparateurs en carton
S'assurer que toutes les fournitures d'échantillonnage se trouvent à portée de la main. Utiliser un petit chariot ou un panier de manutention pour le transport des fournitures vers le point d'échantillonnage. Désinfecter la surface de travail. Se laver les mains et les sécher.
Enfiler une paire de gants stériles en suivant les instructions de la procédure 3 –Comment éponger une carcasse (general)
Enfiler une paire de gants stériles comme décrit dans la procédure-1 –Comment enfiler des gants stériles
Étape 2
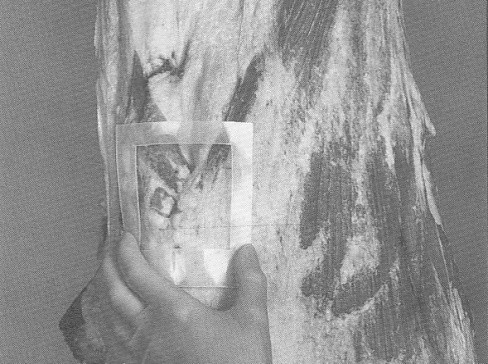
Retirer délicatement l'éponge humectée du sac en la prenant par l'extrémité avec votre main gantée, que vous utiliserez pour faire le prélèvement. Ne pas toucher l'extérieur du sac.
Avec l'autre main gantée, saisir l'extrémité extérieure du gabarit en prenant soin de ne pas contaminer les bords intérieurs qui délimitent la zone d'échantillonnage.
Placer le gabarit sur la zone d'échantillonnage du flanc, et le maintenir en place. Prendre soin de ne pas contaminer la zone délimitée par le gabarit avec les mains.
Étape 3
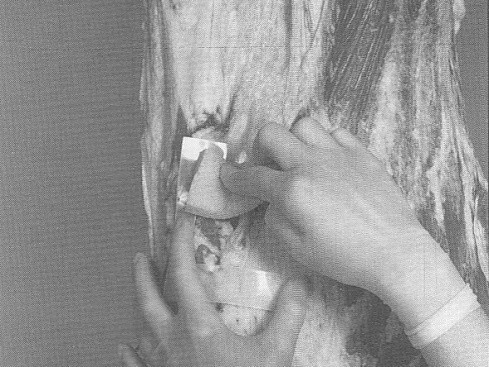
Avec la main utilisée pour le prélèvement, passer l'éponge sur la zone délimitée par le gabarit (5 cm sur 10 cm) environ 10 fois à la verticale et 10 fois à l'horizontale. Utiliser un seul côté de l'éponge.
Note : Il peut être nécessaire de faire basculer le gabarit d'un côté à l'autre pendant l'épongeage étant donné que la surface de la carcasse n'est pas plane. Cette pratique permettra de prélever un échantillon sur une zone de 100 cm2 pendant l'épongeage.
Étape 4

Répéter les étapes 2 et 3 pour la poitrine en utilisant la même face de l'éponge que celle utilisée pour éponger le flanc.
Étape 5

Répéter les étapes 2 et 3 pour la croupe, en utilisant cette fois le côté « propre » de l'éponge (le côté qui n'a pas été utilisé pour éponger le flanc et la poitrine. Après avoir épongé la croupe, prendre le gabarit avec la main utilisée pour le prélèvement. Prendre soin de ne pas contaminer l'éponge. Descendre de l'échelle tout en tenant la rampe avec votre main utilisée pour tenir la rampe. Placer le gabarit de côté pour le jeter plus tard.
3.4 Éponger une carcasse de porc
Objet de cette annexe
La méthodologie est fournie ici pour usage dans des projets spéciaux ou d'autres situations où elle pourrait être requise
Préparation pour la collecte d'un échantillon
- sélectionner un moment pour le prélèvement de l'échantillon. Déterminer les moments où des carcasses refroidies pendant au moins 12 heures seront accessibles. Choisir ensuite au hasard un moment dans ce délai pour le prélèvement des échantillons
- sélectionner le lieu le plus froid à partir duquel prélever l'échantillon. Sélectionner un lieu sécuritaire et accessible dans la chambre froide pour prélever des échantillons à partir d'une carcasse de porc. Ce lieu peut être situé sur la chaîne de transfert, la chaîne de classement, dans une rampe, ou un endroit dégagé dans la chambre froide
- utiliser les techniques aseptiques telles qu'elles sont indiquées au chapitre III, section 3 de la Partie 1.
- se laver et se désinfecter les mains
- désinfecter les surfaces de travail (surfaces qui entreront en contact avec les fournitures au moment de les rassembler)
- rassembler les fournitures
- étiqueter le sac à éponge
- se laver et se désinfecter les mains
- apporter les fournitures au point d'échantillonnage
- désinfecter les surfaces de travail (surfaces qui entreront en contact avec les fournitures pendant l'échantillonnage)
Prélever l'échantillon (par épongeage)
- Au moment aléatoire déterminé, se rendre au lieu d'échantillonnage. Ne pas choisir la carcasse située au lieu déterminé préalablement. Compter plutôt 5 unités en aval ou en amont puis choisir la sixième unité aux fins d'échantillonnage. En comptant 5 carcasses en aval ou en amont, on évite tout biais possible au moment de la sélection. Normalement, il n'est pas nécessaire que l'établissement déplace un grand nombre de carcasses pour en trouver une aléatoirement aux fins d'échantillonnage
Il est possible d'utiliser des carcasses de porc semi-parées régulièrement.
- Éponger la carcasse et préparer l'envoi de l'échantillon (suivre les techniques d'épongeage décrites à la procédure 2 – Préparer l'éponge et le gabarit en vue de la collecte d'échantillons)
- placer l'équipement (penser à la salubrité)
- situer les zones sur la carcasse pour l'échantillonnage
- disposer les fournitures
- ouvrir le sac à éponge
- verser de l'EPT dans le sac à éponge
- fermer le sac et masser l'éponge
- pousser l'éponge vers la partie supérieure du sac, ouvrir le sac et le placer sur une surface désinfectée
- ouvrir le sac du gabarit et le placer sur une surface désinfectée
- enfiler les gants stériles (voir la procédure 1 – enfiler une paire de gants stériles)
- retirer l'éponge
- retirer le gabarit
- appliquer le gabarit sur le flanc. Ne pas toucher à la zone d'échantillonnage
- tenir le gabarit avec une main gantée et utiliser l'autre main pour passer l'éponge sur la zone
- effectuer 10 frottis verticaux sur toute la surface d'échantillonnage, puis 10 frottis horizontaux sur toute la surface d'échantillonnage
- grimper avec prudence pour effectuer l'échantillonnage de la fesse tout en empêchant le gabarit ou l'éponge de toucher à toute autre zone ne faisant pas l'objet de l'échantillonnage
- appliquer le gabarit sur la fesse (voir la section Points d'échantillonnage pour le dépistage sur les carcasses de porc). Ne pas toucher à la zone à échantillonner
- tenir le gabarit avec une main gantée et utiliser l'autre main pour passer l'éponge sur la zone
- effectuer 10 frottis verticaux sur toute la surface d'échantillonnage, puis 10 frottis horizontaux sur toute la surface d'échantillonnage
- grimper avec prudence pour effectuer l'échantillonnage de la bajoue tout en empêchant le gabarit ou l'éponge de toucher à toute autre zone ne faisant pas l'objet de l'échantillonnage
- appliquer le gabarit sur la bajoue (voir la section Points d'échantillonnage pour le dépistage sur les carcasses de porc). Ne pas toucher à la zone à échantillonner
- tenir le gabarit avec une main gantée et utiliser l'autre main pour passer l'éponge sur la zone
- effectuer 10 frottis verticaux sur toute la surface d'échantillonnage, puis 10 frottis horizontaux sur toute la surface d'échantillonnage
- placer l'éponge dans le sac Whirl-Pak® et sceller le sac
- l'échantillon est maintenant complet. Suivre les consignes d'entreposage et d'expédition dans le chapitre VI – Envoyer l'échantillon prélevé
Points d'échantillonnage pour le dépistage sur les carcasses de porc
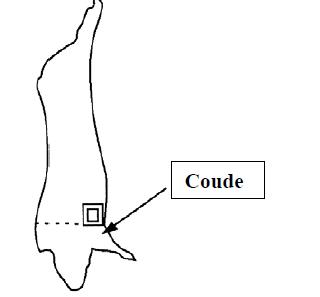
Flanc
Localiser le coude de la carcasse.
Placer le gabarit sur cette zone du flanc (l'aisselle).
Bajoue
Tracer une ligne imaginaire tout droit depuis l'atlas/l'articulation de l'axe vers la ligne médiane ventrale; toute la surface de la peau sous ce point sera considérée comme faisant partie de la bajoue.
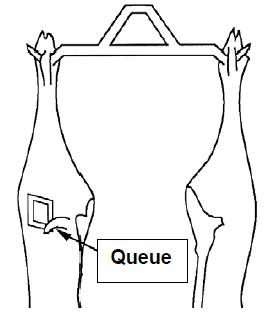
Fesse
À partir de la position dorsale, situer la surface latérale de la base de la queue.
Placer le gabarit sur cette zone de la fesse. Ne pas inclure la base de la queue.
Technique d'échantillonnage à l'épongeage d'une carcasse de porc
Étape 1
Matériel :
- 1 – éponge à spécimens stérile dans un sac Whirl-Pak®
- 1 – 10 ml d'eau peptonnée tamponnée (EPT) stérile et préalablement refroidie
- 1 – gabarit stérile dans un sac
- 1 – paire de gants stériles
- 1 – pochette en plastique de 6 pouces sur 12 pouces pour le formulaire d'échantillonnage dûment rempli
- 1 – formulaire du FSIS 7355-2A/2B Trousse de sceau de sécurité pour échantillon de laboratoire
- 3 – timbres pré-imprimés et facturables FedEx (un pour chacun des laboratoires du FSIS)
- 1 – tampon absorbant
- 1 – bourre en mousse par contenant d'expédition et séparateurs en carton
blocs réfrigérants
S'assurer que toutes les fournitures d'échantillonnage se trouvent à portée de la main. Utiliser un petit chariot ou un panier de manutention pour le transport des fournitures vers le point d'échantillonnage. Désinfecter la surface de travail.
Se laver les mains et les sécher.
Aussi se référer à la procédure 3-comment éponger une carcasse (généralités)
Enfiler une paire de gants stériles en suivant les instructions de la procédure 1 – Enfiler une paire de gants stériles.
Étape 2
Placer le gabarit sur la zone d'échantillonnage du flanc, et le maintenir en place. Prendre soin de ne pas contaminer la zone délimitée par le gabarit avec les mains.
Étape 3
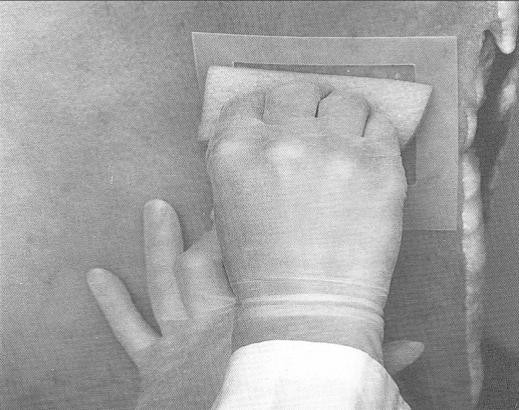
Avec la main utilisée pour le prélèvement, passer l'éponge sur la zone délimitée par le gabarit (5 cm sur 10 cm) environ 10 fois à la verticale et 10 fois à l'horizontale. Utiliser un seul côté de l'éponge.
Note : Il peut être nécessaire de faire basculer le gabarit d'un côté à l'autre pendant l'épongeage étant donné que la surface de la carcasse n'est pas plane. Cette pratique permettra de prélever un échantillon sur une zone de 100 cm2 pendant l'épongeage.
Après avoir épongé le flanc, prendre le gabarit avec la main utilisée pour le prélèvement. Prendre soin de ne pas contaminer les bords intérieurs de la zone d'échantillonnage du gabarit. Monter dans l'échelle ou sur la plate-forme en tenant la rampe avec la main qui n'est pas utilisée pour effectuer l'épongeage. Ce gant est maintenant contaminé et doit être traité en conséquence, donc il ne faut manipuler aucune surface stérile avec ce gant.
Étape 4
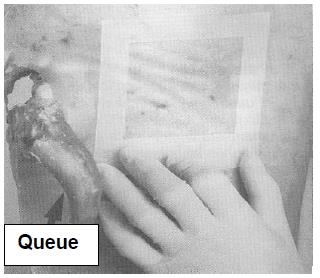
Une fois à la hauteur nécessaire pour échantillonner la fesse, prendre le gabarit avec la main utilisée pour tenir la rampe en prenant soin de ne pas contaminer les bords intérieurs de la zone d'échantillonnage du gabarit ou votre main d'échantillonnage.
Répéter les étapes 2 et 3 pour la fesse en utilisant la même surface de l'éponge que celle utilisée pour éponger le flanc.
Après avoir épongé la fesse, avec soin, prendre le gabarit avec la main qui tient l'éponge (main d'échantillonnage). Ne pas contaminer les bords intérieurs de la zone d'échantillonnage du gabarit. Prendre soin de ne pas contaminer l'éponge.
Descendre de l'échelle tout en tenant la rampe avec votre main utilisée pour tenir la rampe.
Étape 5
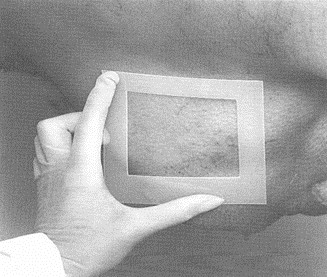
Transférer le gabarit de votre main d'échantillonnage à votre autre main, en prenant soin de ne pas contaminer les bords intérieurs de la zone d'échantillonnage du gabarit.
Répéter les étapes 2 et 3 pour la bajoue, en utilisant cette fois le côté « propre » de l'éponge (le côté qui n'a pas été utilisé pour éponger le flanc et la fesse).
Placer le gabarit de côté pour le jeter plus tard.
Étape 6

Placer l'éponge dans le sac d'échantillonnage. Prendre soin de ne pas toucher l'extérieur du sac avec l'éponge.
Étape 7
Évacuer le surplus d'air qui se trouve dans le sac et repliez le rebord supérieur 3 ou 4 fois afin de le refermer.
Étape 8

Ne pas utiliser 2 sacs pour l'échantillon. Jeter le gabarit. Il faut réfrigérer les échantillons prélevés dans les 5 minutes suivant le prélèvement et les conserver sous réfrigération et sous contrôle du FSIS jusqu'à l'expédition au laboratoire. Répéter les étapes ci-dessus pour chaque demande d'échantillonnage. Utiliser une carcasse distincte pour chaque échantillon.
Addenda 4 - Figures et illustrations
4.1 Exemple de gabarit d'échantillonnage

Gabarit d'échantillonnage par épongeage pour le bœuf et le porc = 10 x 10 cm
4.2 Site d'échantillonnage pour les tests de dépistage de E. coli sur les bovins, les ovins, les caprins et les équins
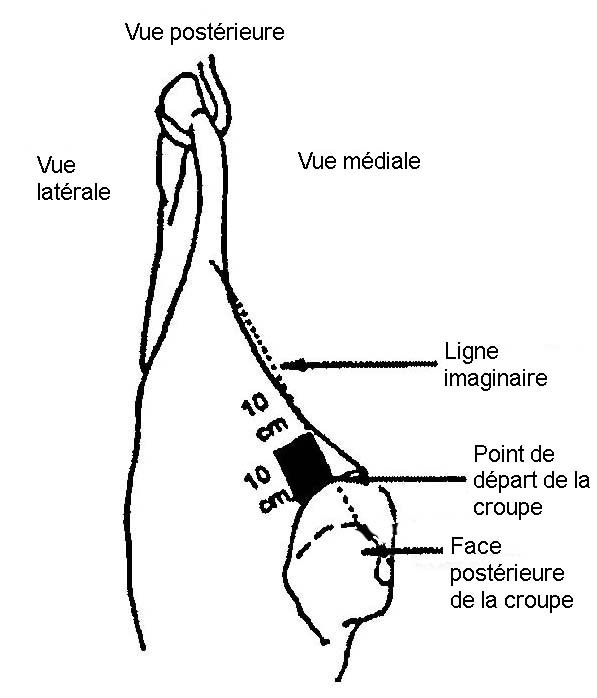
Croupe
Repérer la face postérieure de l'os de la croupe. Tracer une ligne imaginaire en direction du tendon d'Achille. A l'endroit où la ligne recoupe la surface coupée de la ronde se trouve le point de départ pour l'échantillonnage de la croupe.
Mesurer 10 cm vers le haut sur la ligne menant au tendon d'Achille, puis 10 cm vers le côté (latéralement), 10 cm vers la surface coupée de la ronde, et enfin 10 cm le long de la surface coupée de manière de former un carré de 10 x 10 cm.
Note : L'illustration du haut a été volontairement modifiée. Une vraie vue latérale de la carcasse ne nous permettrait pas de voir l'os de la croupe. Une vue médiale ne nous permettrait pas de voir toute la superficie d'échantillonnage de 10 x 10 cm. Ainsi, nous présentons une vue latérale dans laquelle une partie de la ronde a été retirée afin qu'on puisse voir l'emplacement de l'os de la croupe.
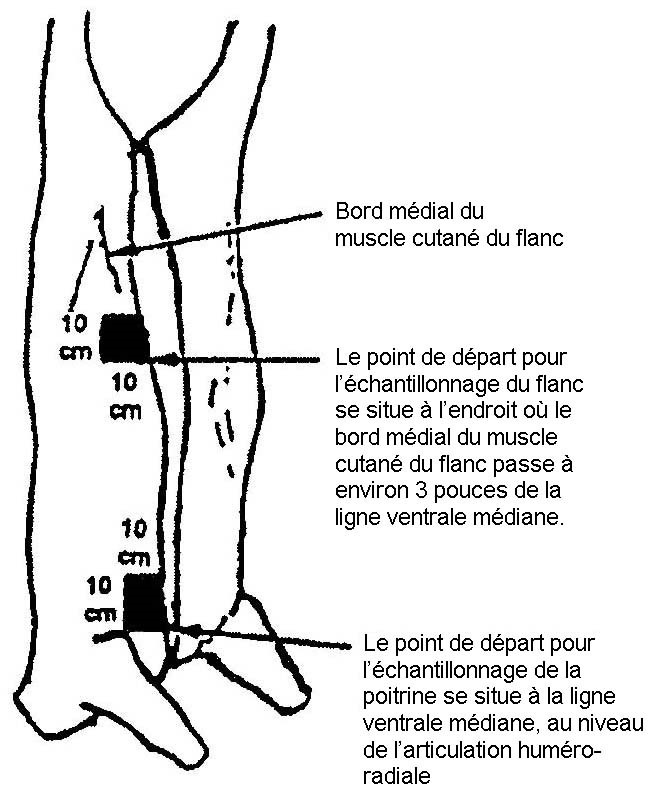
Flanc
Repérer le muscle cutané du flanc (grand oblique de l'abdomen) et suivre le bord médial du muscle vers le bas jusqu'à un point situé à environ 3 pouces de la ligne ventrale médiane. Ce point servira de point de départ pour la mesure. Mesurer vers le haut 10 cm (environ 4 pouces) le long d'une ligne située à environ 3 pouces de la ligne ventrale médiane (mesurer vers le haut ou parallèlement à la ligne ventrale médiane), ensuite mesurer 10 cm (environ 4 pouces) vers (latéralement) de manière à délimiter un carré de 10 cm de large sur 10 cm de long.
Poitrine
Localisez le coude de la carcasse. Tracez une ligne imaginaire directement (médialement) jusqu'à la coupe médiane. Ce sera le point de départ. Mesurer le long de la ligne médiane de 10 cm (environ 4 "), puis sur 10 cm (environ 4") pour former un échantillon carré de 10 cm de large par 10 cm de long.
Remarque : la taille du modèle pour les moutons et les chèvres est de 5 x 10 cm
4.3 Sites d'échantillonnage (épongeage) des carcasses non-écorchées
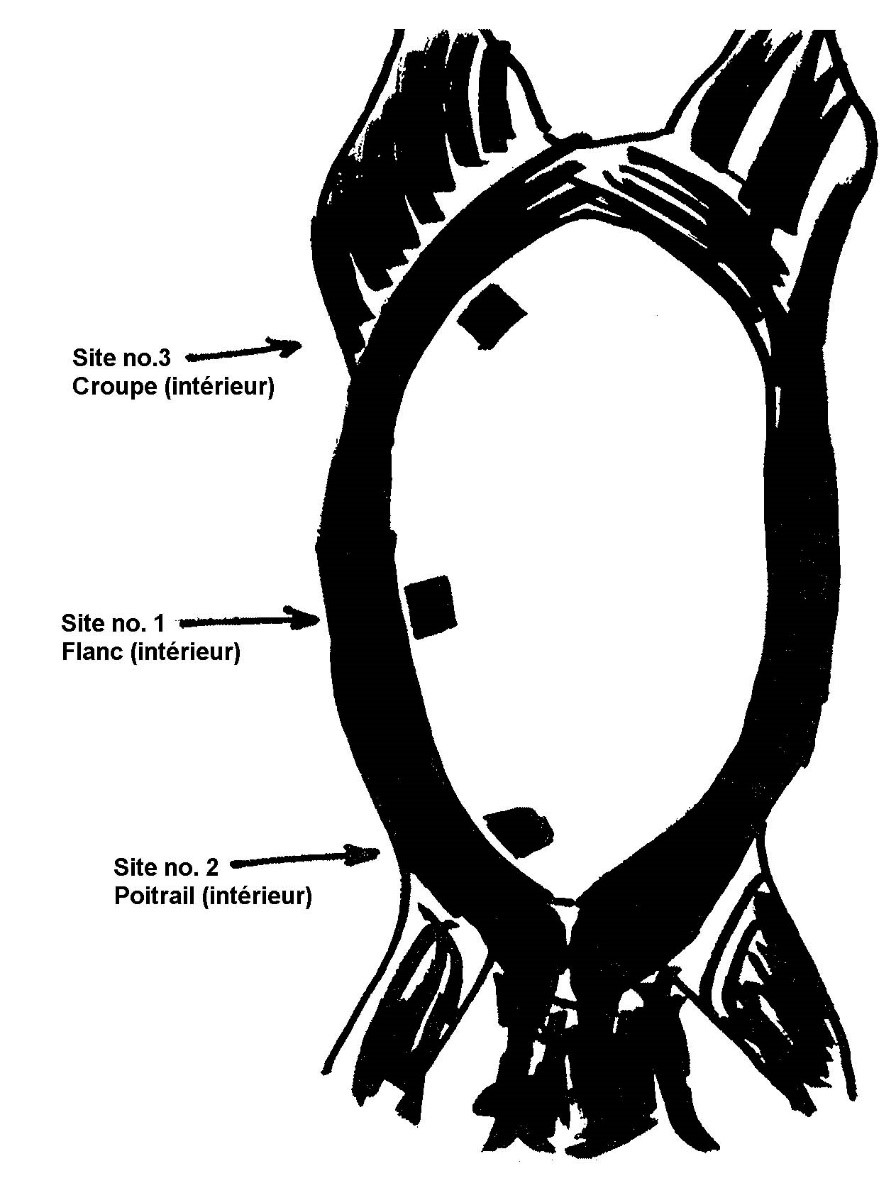
Carcasses non écorchées
La procédure d'échantillonnage est identique sauf que les sites d'échantillonnage sont différents
Des échantillons sur une carcasse de veau non écorchée doivent être prélevés sur:
1er site d'échantillonnage: à l'intérieur du flanc, puis
2ème site d'échantillonnage: à l'intérieur de la poitrine, et enfin
3e site d'échantillonnage: à l'intérieur de la croupe
4.4 Sites d'échantillonnage pour les tests de dépistage de E. coli sur les carcasses de porcs
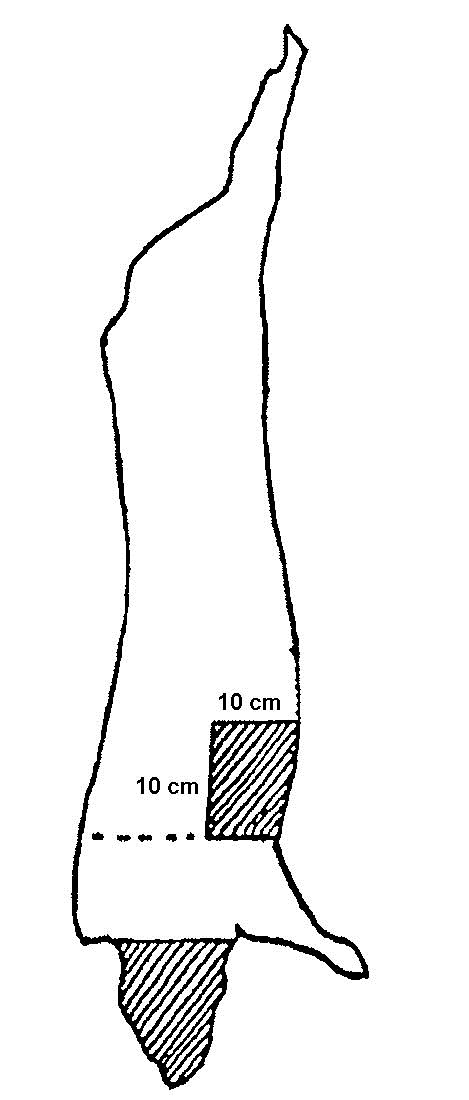
Poitrine
Repérer l'articulation du coude (huméro-radiale) de la carcasse. Tracer une ligne imaginaire latéralement jusqu'à la ligne ventrale médiane. Ce point servira de point de départ. Mesurer 10 cm (environ 4 pouces) vers le haut le long de la ligne ventrale médiane, puis 10 cm latéralement afin de compléter le carré de 10 cm sur 10 cm. C'est sur ce carré mesurant 100 cm2 de superficie qu'on prélèvera l'échantillon de la poitrine.
Bajoue
Tracer une ligne imaginaire à partir de l'atlas/rachis jusqu'à la ligne ventrale médiane; toute la peau située en-dessous sera considérée comme la bajoue.
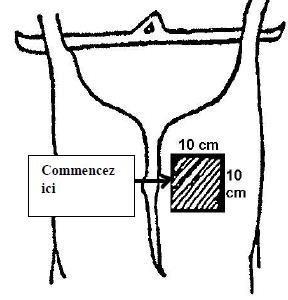
Fesse
À partir d'une position dorsale, repérer la surface latérale de la base de la queue et mesure 5 cm vers le haut (direction caudale) le long du rebord latéral de la marge de gras exposée, puis mesurer 10 cm vers le côté. Ensuite, mesurer 10 cm vers le bas (antérieur), ensuite 10 cm vers le côté, puis 5 cm vers le haut (postérieur) afin de délimiter une zone d'échantillonnage rectangulaire de 10 cm sur 5 cm.
4.5 Graphique de contrôle de procédé - exemple
E. coli (cfu/ml) – Échelle logarithmique
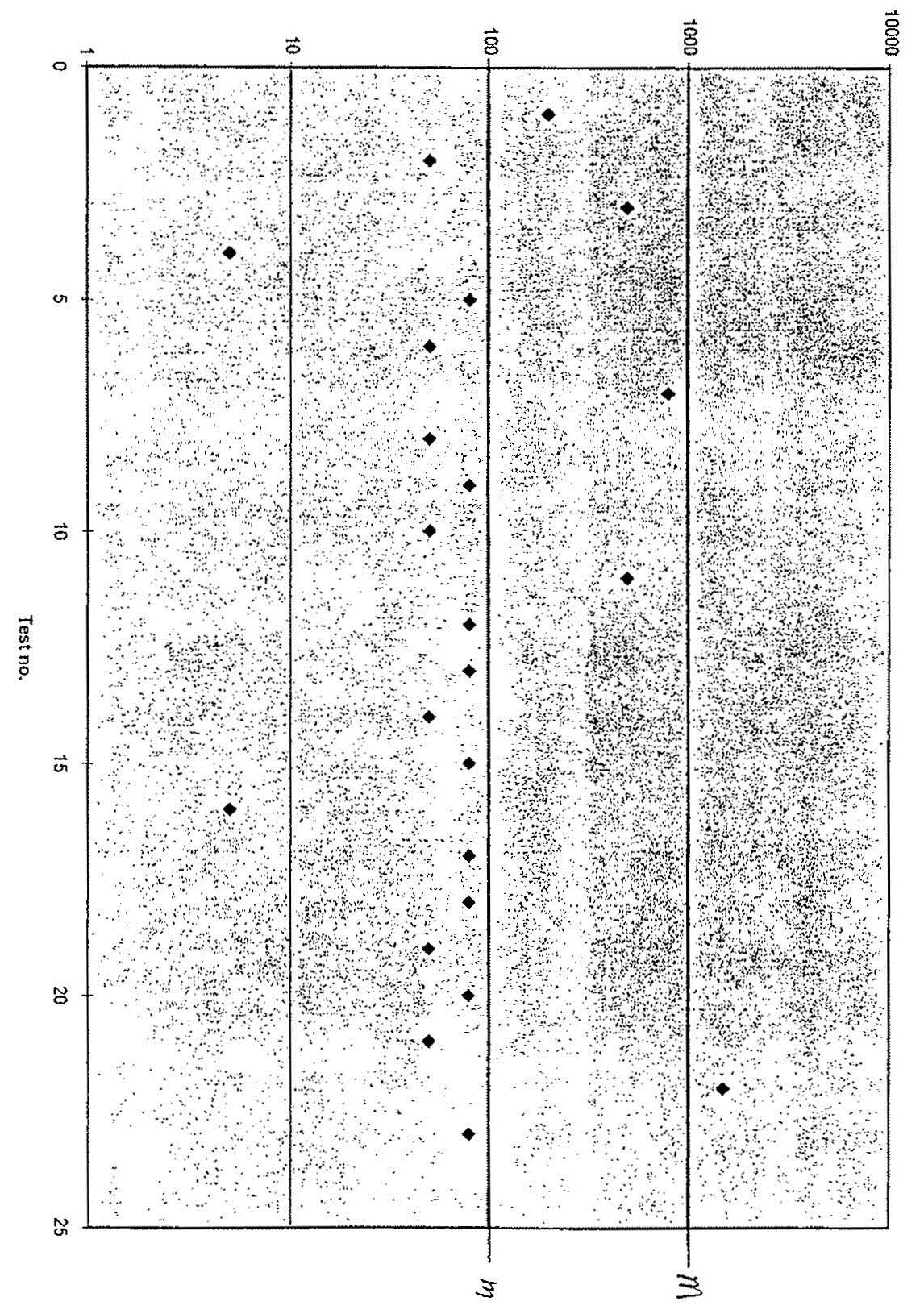
Figure 39 : Graphique de contrôle de procédé – Exemple
Les chiffres sur l'axe horizontal du graphique (axe des x) font référence au numéro du test. Les résultats du test cfu/ml de E. coli en échelle logarithmique sont présentés dans le graphique ci-dessus.
Des exemples supplémentaires sont fournis dans les FSIS Guideline: Modernization of Swine Slaughter Inspection Developing Microbiological Sampling Programs in Swine Slaughter Establishments September 2019 (en anglais seulement).
- Date de modification :